1. 领域背景与文献引入
文献英文标题:Proteomics in pancreatic cancer;发表期刊:Biomark Res;影响因子:未公开;研究领域:肿瘤蛋白质组学(细分领域:胰腺癌蛋白质组学)。
胰腺癌是全球范围内死亡率最高的恶性肿瘤之一,其5年生存率不足10%,主要归因于早期诊断困难(约80%患者确诊时已处于晚期)、缺乏高敏感性/特异性生物标志物(现有标志物如CA19-9存在Lewis抗原阴性人群局限性)及治疗耐药性(化疗、免疫治疗效果有限)。蛋白质组学作为后基因组时代的核心技术,通过质谱(MS)、定量分析等手段直接解析蛋白质的表达、修饰及相互作用,为胰腺癌的机制研究和临床转化提供了关键工具。近年来,领域热点集中于:(1)寻找早期诊断生物标志物(如血清、外泌体蛋白质);(2)解析肿瘤微环境与蛋白质组的相互作用;(3)识别治疗靶点(如代谢重编程相关蛋白质);(4)探索蛋白质翻译后修饰(PTM)的调控作用。然而,现有研究仍面临样本异质性大、技术标准化不足、低丰度蛋白质检测困难等问题,亟需系统整合最新进展以指导临床应用。本文正是基于这一背景,系统总结了胰腺癌蛋白质组学的研究成果,涵盖生物标志物发现、信号通路解析及治疗靶点识别,为胰腺癌的早期诊断和精准治疗提供了新见解。
2. 文献综述解析
本文综述的核心逻辑围绕“生物标志物-信号通路-治疗靶点”三大方向展开,作者将现有研究按样本类型(血清、尿液、外泌体、组织)和研究目的(诊断、预后、机制)分类,系统评述了胰腺癌蛋白质组学的发展脉络。
现有研究的关键结论包括:(1)生物标志物:CA19-9是临床常用但局限性显著(敏感性50-75%、特异性约83%);外泌体蛋白质如糖蛋白1(GPC1)在早期患者血清中高表达(AUC=0.94),有望成为非侵入性诊断标志物;(2)信号通路:KRAS突变驱动下游RAF/MEK/ERK通路激活,促进肿瘤增殖;PI3K/AKT/mTOR通路调控糖酵解重编程(如PGAM1、LDHA参与);(3)治疗靶点:代谢相关蛋白质(LDHA、PGAM1)、PTM相关酶(HDAC)及信号通路蛋白(MEK)是潜在干预位点。技术方法的优势在于质谱的高灵敏度(检测低丰度蛋白质)和定量蛋白质组学的准确性(量化表达差异),但局限性包括样本预处理变异性大、不同研究结果难以比较。
本文的创新价值在于:(1)系统整合:首次将胰腺癌蛋白质组学的分散研究整合为“生物标志物-信号通路-治疗靶点”的完整体系;(2)强调PTM与微环境:突出组蛋白乙酰化、磷酸化等修饰及肿瘤微环境中stromal细胞的蛋白质通讯机制;(3)外泌体聚焦:总结外泌体蛋白质组学的最新进展,提出其作为早期诊断标志物的潜力;(4)临床转化导向:明确了蛋白质组学在精准治疗中的应用方向(如代谢抑制剂、PTM调节剂)。
3. 研究思路总结与详细解析
3.1 整体框架
本文研究目标是总结胰腺癌蛋白质组学进展,识别生物标志物与治疗靶点;核心科学问题包括:胰腺癌蛋白质组的变化规律、有效生物标志物的筛选、信号通路的蛋白质调控机制;技术路线为“文献检索-数据整合-分类分析-结论总结”,覆盖2010-2025年PubMed、Web of Science数据库中100余篇关键研究。
3.2 生物标志物筛选与验证
实验目的:识别胰腺癌诊断、预后生物标志物。
方法细节:整合血清、尿液、外泌体及组织样本的研究,技术包括质谱(LC-MS/MS)、酶联免疫吸附试验(ELISA)、免疫组化(IHC)及外泌体分离(超速离心、免疫亲和捕获)。
结果解读:(1)血清标志物:TIMP1与LRG1组合的AUC=0.949(n=187),显著优于CA19-9;(2)尿液标志物:中性粒细胞明胶酶相关脂质运载蛋白(NGAL)的AUC=0.887(n=50),适用于无创筛查;(3)外泌体标志物:GPC1在早期患者血清中高表达(敏感性85%、特异性90%,n=100);(4)组织标志物:annexin A10在胰腺上皮内瘤变(PanIN)中高表达,与肿瘤进展相关(P<0.01,n=100)。
产品关联:实验所用关键产品包括Thermo Fisher Orbitrap质谱仪、Invitrogen外泌体分离试剂盒、R&D Systems CA19-9 ELISA试剂盒;领域常规使用Abcam GPC1抗体、Qiagen TaqMan定量PCR试剂盒。
3.3 信号通路解析
实验目的:解析胰腺癌关键信号通路的蛋白质调控机制。
方法细节:分析KRAS、PI3K/AKT/mTOR、Wnt/β-catenin等通路,技术包括定量蛋白质组学(TMT、DIA)、Western blot及基因编辑(siRNA、CRISPR-Cas9)。
结果解读:(1)KRAS通路:突变导致RAF/MEK/ERK磷酸化,促进代谢蛋白质RPIA参与戊糖磷酸途径(提供核苷酸);(2)PI3K/AKT/mTOR通路:AKT Ser473磷酸化激活mTOR,上调PGAM1促进糖酵解;(3)Wnt/β-catenin通路:β-catenin核转移诱导MYC、Cyclin D1表达,加速细胞周期;(4)PTM调控:组蛋白H3K9ac乙酰化上调 oncogene表达,AKT磷酸化增强信号传导。
产品关联:实验所用关键产品包括Cell Signaling Technology AKT抗体、Addgene CRISPR-Cas9试剂盒、Thermo Fisher TMT 10-plex定量试剂盒;领域常规使用Promega CCK-8细胞增殖试剂盒、BD Annexin V凋亡检测试剂盒。
3.4 治疗靶点识别
实验目的:识别胰腺癌潜在治疗靶点。
方法细节:评估代谢、信号通路及PTM相关蛋白质的治疗潜力,技术包括小分子抑制剂、动物实验(裸鼠异种移植模型)。
结果解读:(1)代谢靶点:LDHA抑制剂oxamate抑制糖酵解,减少肿瘤能量供应;PGAM1抑制剂ML239抑制增殖与转移;(2)信号通路靶点:MEK抑制剂trametinib阻断KRAS下游通路,降低肿瘤生长速率;(3)PTM靶点:HDAC抑制剂romidepsin下调组蛋白去乙酰化,抑制 oncogene表达;(4)外泌体靶点:GW4869抑制外泌体分泌,减少肿瘤转移。
产品关联:实验所用关键产品包括Selleck oxamate抑制剂、Jackson Laboratory裸鼠;领域常规使用Sigma-Aldrich细胞培养试剂。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本文涉及的Biomarker类型包括血清(CA19-9、TIMP1/LRG1)、尿液(NGAL)、外泌体(GPC1)、组织(annexin A10),筛选遵循“临床样本筛选-细胞系验证-动物模型验证-大样本临床验证”的完整链条。例如GPC1的研究:首先在胰腺癌患者血清外泌体中发现高表达(临床筛选),随后在PANC-1细胞系中验证其促增殖功能(细胞验证),再通过裸鼠模型确认其促转移作用(动物验证),最后在100例临床样本中确认诊断价值(大样本验证)。
4.2 研究过程与核心成果
(1)来源与验证:
- 血清Biomarker:来自胰腺癌患者(n=187)、健康对照(n=169)及良性胰腺疾病患者(n=93),通过ELISA验证;
- 尿液Biomarker:来自胰腺癌患者(n=50)与健康对照(n=50),通过ELISA验证;
- 外泌体Biomarker:来自胰腺癌患者血清(n=100)与细胞系(PANC-1、MIA PaCa-2),通过质谱及Western blot验证;
- 组织Biomarker:来自胰腺癌手术标本(n=100)与正常胰腺组织(n=50),通过免疫组化验证。
(2)特异性与敏感性:
- GPC1:敏感性85%、特异性90%(n=100);
- TIMP1/LRG1组合:AUC=0.949(n=187);
- NGAL:AUC=0.887(n=50)。
(3)核心成果:
- 早期诊断:外泌体GPC1的诊断价值优于CA19-9(AUC=0.94 vs 0.75),适合早期筛查;
- 预后评估:组织annexin A10高表达患者5年生存率(15%)显著低于低表达者(35%,P<0.01);
- 无创检测:尿液NGAL为高危人群提供了便捷的筛查手段。
关键图片说明
- 胰腺导管腺癌(PDAC)进展机制:
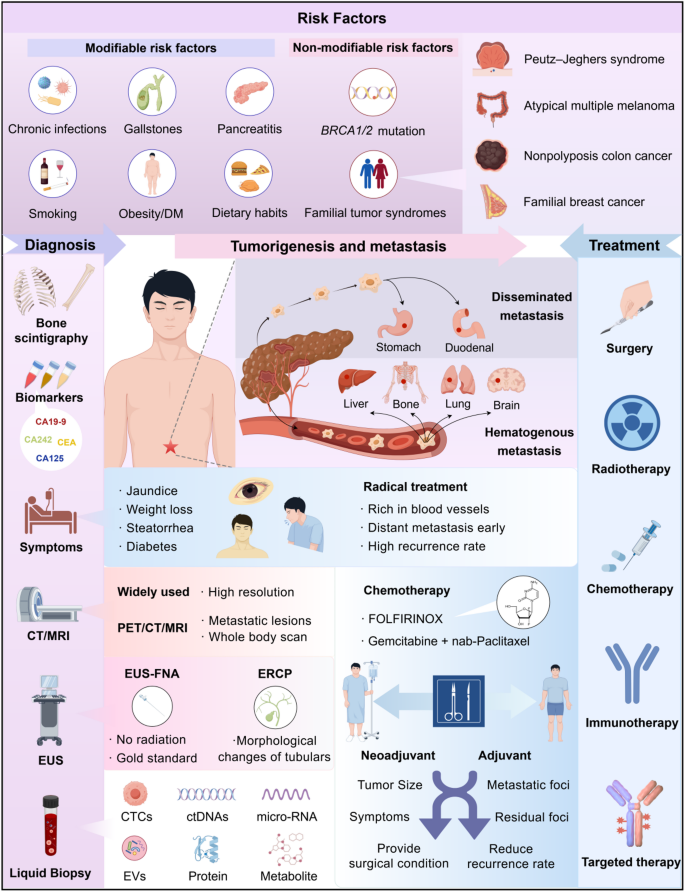
(展示PanIN进展为PDAC的分子路径)
- 蛋白质组学技术发展:
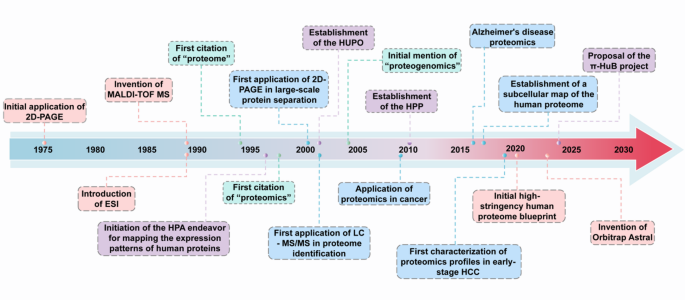
(涵盖MALDI-TOF、ESI等质谱技术及定量方法)
- 外泌体分离与分析流程:
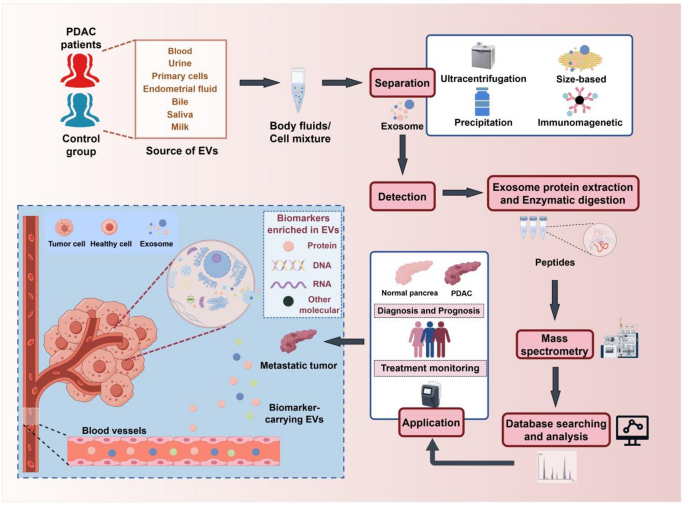
(展示外泌体提取、蛋白质检测的技术路线)
- KRAS信号通路:
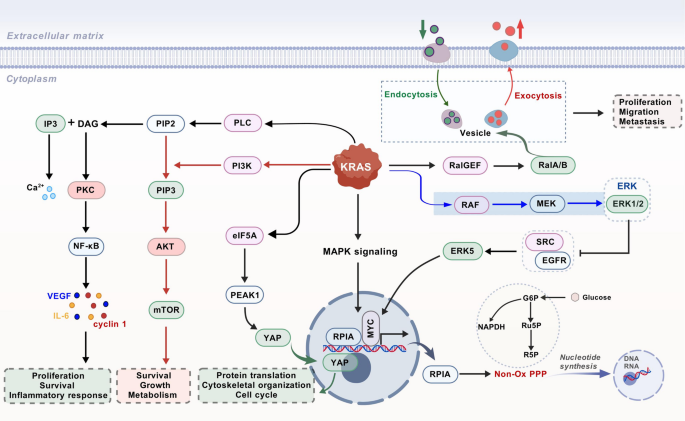
(解析KRAS下游的代谢与增殖调控)
本文通过系统整合胰腺癌蛋白质组学的最新进展,明确了外泌体GPC1、TIMP1/LRG1组合等生物标志物的临床潜力,揭示了KRAS、PI3K/AKT/mTOR等通路的蛋白质调控机制,为胰腺癌的早期诊断和精准治疗提供了重要理论基础。未来研究需聚焦技术标准化、时空蛋白质组学及临床转化验证,推动蛋白质组学在胰腺癌中的实际应用。
