1. 领域背景与文献引入
文献英文标题:Proteomic and histopathologic profiling reveal molecular features and clinical biomarkers of coronary atherosclerosis;发表期刊:Biomark Res;影响因子:未公开;研究领域:冠状动脉粥样硬化分子特征与临床生物标志物。
冠状动脉粥样硬化是全球心血管疾病死亡的主要驱动因素,但其斑块进展过程中的分子特征尚未完全阐明,限制了早期诊断与斑块不稳定风险的评估。领域共识:现有研究多聚焦于动物模型或单一病理阶段的蛋白质组分析,缺乏人类冠状动脉样本的阶段特异性综合解析,且临床生物标志物多依赖传统炎症指标(如高敏C反应蛋白),敏感性与特异性不足。针对这一空白,本研究通过整合人类冠状动脉组织的蛋白质组学与组织病理学分析,系统揭示斑块进展的分子通路,并转化为临床可用的生物标志物,为冠状动脉疾病(CAD)的早期检测提供新依据。
2. 文献综述解析
文献综述核心评述逻辑围绕“冠状动脉粥样硬化分子机制的研究缺口”展开:作者指出,现有研究对冠状动脉粥样硬化的蛋白质组动态变化理解有限,尤其是斑块起始(AIT→PIT)与 destabilization(FA→TCFA→RP)阶段的分子调控机制未明确;多数研究基于动物模型或外周血样本,缺乏人类病变组织的直接证据;临床生物标志物的识别多集中在单一疾病阶段,难以覆盖疾病全程。
现有研究的关键结论包括:补体与凝血通路、细胞外基质(ECM)重塑参与动脉粥样硬化,但缺乏阶段特异性关联;生物标志物如CRP、肌钙蛋白仅能反映晚期炎症或心肌损伤,无法早期预测斑块风险。技术方法的局限性体现在:传统蛋白质组学多针对混合组织,难以区分细胞特异性贡献;生物标志物验证多为小样本,缺乏外部队列支持。
本研究的创新价值在于:首次对人类冠状动脉的5个组织病理学阶段(适应性内膜增厚AIT、病理性内膜增厚PIT、纤维斑块FA、薄帽纤维斑块TCFA、破裂斑块RP)进行蛋白质组学与组织病理学的综合分析,结合单细胞RNA测序定位通路的细胞来源,并通过血浆蛋白质组学筛选出覆盖疾病全程的生物标志物,填补了“组织阶段特异性分子特征→临床生物标志物”的转化缺口。
3. 研究思路总结与详细解析
本研究的整体框架:以“揭示冠状动脉粥样硬化的阶段特异性蛋白质组特征→识别临床生物标志物”为目标,核心科学问题是“不同病理阶段的蛋白质组动态变化及可转化的生物标志物”;技术路线为“组织样本收集→蛋白质组学分析→通路富集→单细胞RNA测序整合→血浆生物标志物筛选→多队列验证”。
3.1 冠状动脉组织样本收集与组织病理学分期
实验目的是获取人类冠状动脉样本并按改良AHA标准进行病理分期,为后续蛋白质组学分析提供基础。方法细节:收集4例缺血性心肌病患者的20个冠状动脉节段(每例患者5个阶段各1个样本),通过组织病理学染色(如HE染色、Masson染色)分为AIT、PIT、FA、TCFA、RP 5个阶段(n=4/阶段)。结果解读:成功完成所有样本的分期,各阶段的组织学特征与改良AHA标准一致(如AIT表现为内膜轻度增厚,RP可见纤维帽破裂及血栓形成)。文献未提及具体实验产品,领域常规使用组织病理学染色试剂盒(如HE染色试剂盒、Masson三色染色试剂盒)。
3.2 冠状动脉组织蛋白质组学分析与通路富集
实验目的是解析不同病理阶段的蛋白质组动态变化,识别关键分子通路。方法细节:对20个样本进行蛋白质组学检测(LC-MS/MS),通过加权基因共表达网络分析(WGCNA)构建蛋白共表达模块,结合PLS-DA分析阶段间差异,K-means聚类识别蛋白表达模式。结果解读:WGCNA识别12个与疾病进展相关的模块,其中补体与凝血通路、ECM组织通路的模块得分随阶段进展显著升高(n=4/阶段,P<0.05);PLS-DA显示阶段间蛋白质组差异显著,TCFA与RP阶段的蛋白谱更接近;K-means聚类将397个差异蛋白分为4个簇,簇1(补体与凝血通路)随阶段进展持续上调,簇3(ECM组织)在PIT阶段升高后稳定。文献未提及具体实验产品,领域常规使用蛋白质组学检测平台(如Thermo Fisher Q Exactive HF)及生物信息学软件(如WGCNA、ClusterProfiler)。
3.3 单细胞RNA测序数据整合与细胞类型定位
实验目的是将蛋白质组学结果与细胞类型关联,明确通路的细胞来源。方法细节:整合已发表的人类冠状动脉单细胞RNA测序数据(涵盖内皮细胞、成纤维细胞、巨噬细胞、平滑肌细胞等),通过UMAP投影与拟时序分析,定位补体与ECM通路的细胞亚型。结果解读:补体通路主要在成纤维细胞与巨噬细胞(尤其是组织驻留巨噬细胞Mac.Resident)中上调,ECM组织通路在成纤维细胞与平滑肌细胞(尤其是肌成纤维细胞Fibromyocytes)中升高;拟时序分析显示,单核细胞向巨噬细胞分化过程中补体通路活性渐进性增强,平滑肌细胞向成纤维细胞转化时ECM通路活性升高。文献未提及具体实验产品,领域常规使用单细胞测序平台(如10x Genomics Chromium)及分析软件(如Seurat、Monocle)。
3.4 血浆样本收集与生物标志物筛选
实验目的是从血浆中筛选与CAD相关的生物标志物。方法细节:在发现队列(80例,含40例对照、40例CAD患者)中进行血浆蛋白质组学检测,通过Venn图筛选“组织差异蛋白→补体/ECM通路→血浆蛋白”的重叠蛋白(共65个),再通过LASSO回归筛选出3个核心生物标志物(THBS1、ECM2、C1R)。结果解读:LASSO回归显示这3个蛋白的系数最高,且其血浆水平与组织中的表达趋势一致(如THBS1在TCFA/RP阶段显著升高)。文献未提及具体实验产品,领域常规使用血浆蛋白质组学试剂盒(如Agilent Multiple Reaction Monitoring)及统计软件(如R包glmnet)。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究涉及的Biomarker为血浆蛋白THBS1、ECM2、C1R,属于“疾病诊断与风险分层标志物”。筛选逻辑为“组织蛋白质组学(关键通路蛋白)→血浆蛋白质组学(重叠蛋白)→LASSO回归(核心标志物)→多队列验证”,覆盖“组织分子特征→临床可测指标”的转化过程。
研究过程详述
Biomarker 来源为发现队列(80例)与外部验证队列(113例)的血浆样本。验证方法:发现队列中通过蛋白质组学检测,验证队列中通过ELISA定量检测。特异性与敏感性数据:发现队列中,3个 biomarker 组合区分CAD与对照的AUC为0.831(训练集,n=40)、0.764(测试集,n=40);区分稳定CAD与对照的AUC为0.765(n=20),识别ACS患者的AUC为0.786(n=20)。外部验证队列中,组合 biomarker 区分稳定CAD与对照的AUC为0.841(n=25对照,n=44稳定CAD),识别ACS患者的AUC为0.822(n=44 ACS)。此外,THBS1、ECM2、C1R的血浆水平与SYNTAX评分(CAD严重程度指标)呈正相关(Spearman相关系数分别为0.42、0.38、0.35,P<0.05)。
核心成果提炼
本研究的核心成果是建立了THBS1+ECM2+C1R的三蛋白生物标志物组合,其创新性体现在:1)首次将冠状动脉组织的阶段特异性蛋白质组特征转化为血浆生物标志物,覆盖CAD的“起始→稳定→不稳定”全程;2)生物标志物与CAD严重程度相关,可用于风险分层;3)在多队列中验证了性能,优于传统标志物(如hs-CRP的AUC为0.697,低于组合标志物的0.869)。此外,生物标志物的分子机制与补体、ECM通路相关,为CAD的病理机制研究提供了新线索。
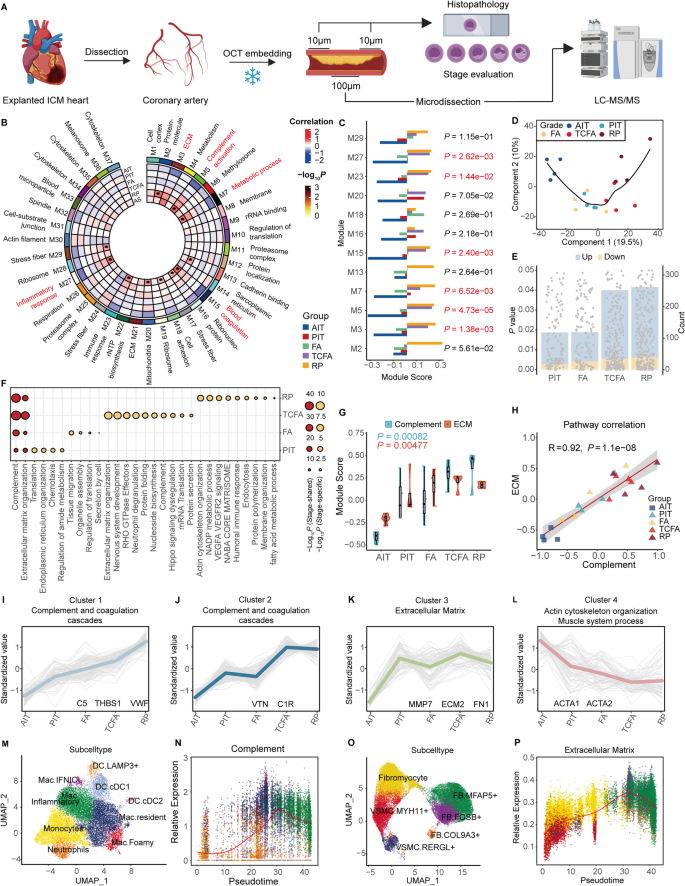
图1 冠状动脉粥样硬化不同病理阶段的蛋白质组学与组织病理学分析。A. 样本获取与分析 workflow;B. WGCNA蛋白共表达模块与病理阶段的关联;C. 关键模块的阶段特异性得分;D. PLS-DA的阶段区分;E. 各阶段与AIT的差异蛋白数量;F. 通路富集分析;G. 补体与ECM通路的ssGSEA得分;H. 通路活性相关性;I-L. K-means聚类的4个簇;M-N. 巨噬细胞亚型的补体通路拟时序分析;O-P. 成纤维细胞/平滑肌细胞的ECM通路拟时序分析
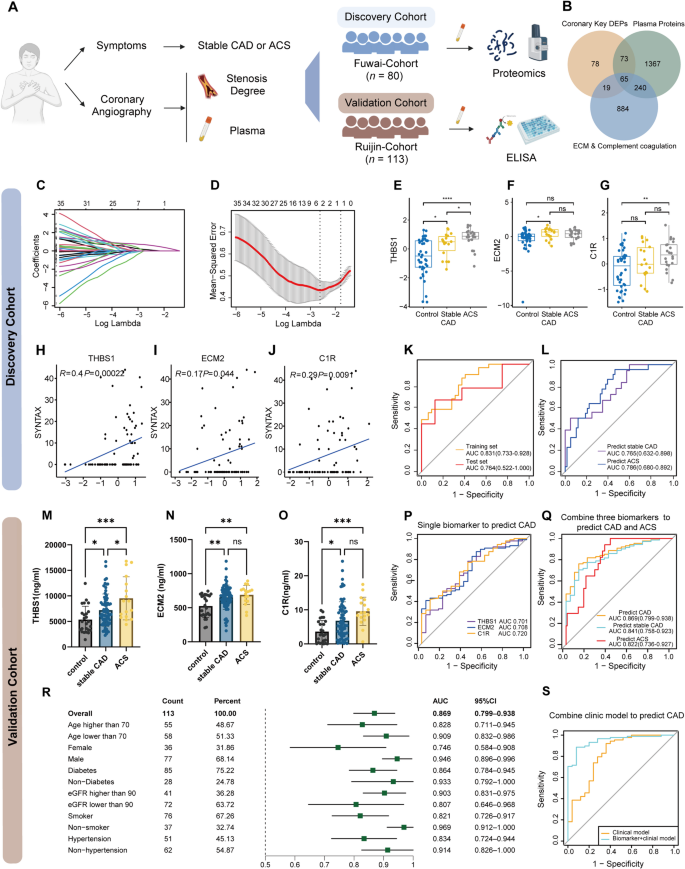
图2 冠状动脉疾病生物标志物的发现与验证。A. 生物标志物筛选与验证的 study design;B. 组织与血浆蛋白的重叠策略;C-D. LASSO回归的系数与Lambda选择;E-G. 发现队列中THBS1、ECM2、C1R的水平差异;H-J. 与SYNTAX评分的相关性;K. 训练集与测试集的ROC曲线;L. 发现队列的亚组ROC曲线;M-O. 验证队列中的水平差异;P. 单一 biomarker 的ROC曲线;Q. 验证队列的组合 biomarker ROC曲线;R. 亚组分析的AUC值;S. 生物标志物+临床模型的ROC曲线
