1. 领域背景与文献引入
文献英文标题:HMGA1 augments palbociclib efficacy via PI3K/mTOR signaling in intrahepatic cholangiocarcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝内胆管癌(iCCA)靶向治疗。
肝内胆管癌(iCCA)是起源于肝内胆管上皮细胞的高度侵袭性恶性肿瘤,为第二常见的原发性肝癌,占所有胆管癌的20%左右。近年来其发病率和死亡率呈上升趋势,尤其在亚洲地区(如中国、韩国)更为显著。iCCA临床诊断困难,多数患者确诊时已达晚期,失去手术根治机会,5年总体生存率仅约3%,中位生存期不足12个月。尽管吉西他滨联合顺铂等化疗方案是晚期iCCA的一线治疗,但耐药性普遍存在,疗效有限。靶向治疗方面,仅FGFR2抑制剂pemigatinib获批用于FGFR2融合阳性患者,适用人群狭窄。因此,探索iCCA的发病机制及新型靶向治疗策略是当前领域的核心需求。
高迁移率族蛋白A1(HMGA1)是一种结构转录因子,在多种恶性肿瘤(如肝细胞癌、胰腺癌、结直肠癌)中过表达,通过调控下游靶基因的转录促进肿瘤增殖、转移及干细胞性。已有研究提示HMGA1在胆管癌中过表达,但具体机制及靶向价值尚未明确。此外,细胞周期蛋白D1(CCND1)/细胞周期蛋白依赖性激酶4/6(CDK4/6)通路是iCCA的关键驱动通路,CDK4/6抑制剂palbociclib单药治疗iCCA的疗效有限,其耐药机制与PI3K/Akt/mTOR通路激活密切相关。基于此,本研究聚焦HMGA1在iCCA中的作用及机制,评估CDK4/6与PI3K/mTOR联合抑制的疗效,为iCCA的精准治疗提供新范式。
2. 文献综述解析
作者通过“iCCA临床困境→HMGA1的促癌作用→CDK4/6抑制剂的耐药问题→PI3K/mTOR通路的调控角色”的逻辑,对现有研究进行分类评述。现有研究的关键结论包括:(1)iCCA预后极差,缺乏有效靶向治疗;(2)HMGA1通过调控转录在多种癌症中发挥促癌作用,但其在iCCA中的具体靶基因及通路未明;(3)CDK4/6抑制剂单药治疗iCCA的短期疗效显著,但长期易出现耐药;(4)PI3K/Akt/mTOR通路激活是CDK4/6抑制剂耐药的重要机制,联合抑制可能逆转耐药。
现有研究的局限性主要体现在:(1)HMGA1在iCCA中的分子机制研究不足;(2)CDK4/6抑制剂单药治疗的耐药问题未得到有效解决;(3)CDK4/6与PI3K/mTOR联合抑制在iCCA中的协同作用及机制尚未明确。
本研究的创新点在于:(1)首次揭示HMGA1通过“促进CCND1转录+激活PI3K/Akt/mTOR通路”双机制驱动iCCA进展;(2)证实CDK4/6抑制剂palbociclib与PI3K/mTOR抑制剂PF-04691502联合治疗可通过协同抑制细胞周期、干细胞性及转移,显著增强iCCA疗效;(3)为HMGA1高表达的iCCA患者提供了“靶向联合治疗”的新策略。
3. 研究思路总结与详细解析
本研究以“HMGA1在iCCA中的作用→机制→靶向干预”为核心逻辑,构建“数据库分析→临床样本验证→细胞实验→动物模型→联合治疗验证”的闭环研究路线,核心目标是明确HMGA1的作用机制及联合治疗的疗效。
3.1 HMGA1在iCCA中的表达及功能验证
实验目的:明确HMGA1在iCCA中的表达特征及对肿瘤进展的影响。
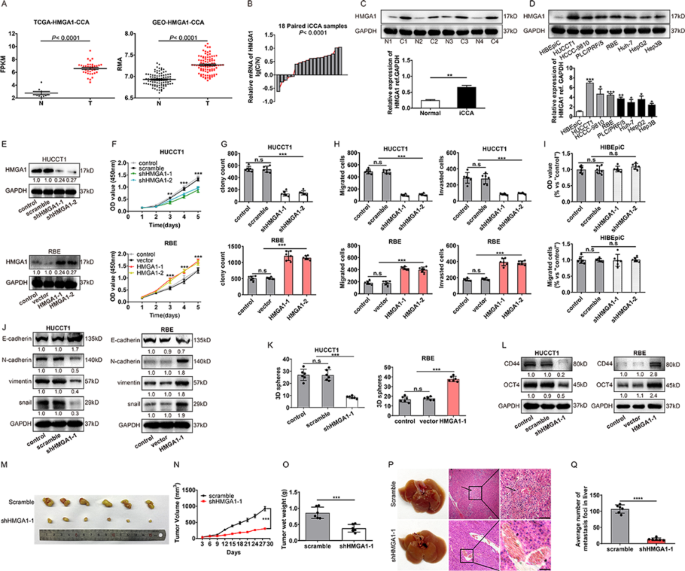
方法:(1)分析TCGA、GEO(GSE76311)数据库iCCA样本的HMGA1表达;(2)收集18对iCCA及癌旁组织,用qPCR、蛋白质免疫印迹(WB)检测HMGA1的mRNA和蛋白水平;(3)构建HMGA1敲减(shRNA)/过表达的iCCA细胞系(HUCCT1、RBE),通过CCK-8、克隆形成、Transwell实验检测增殖、迁移及侵袭能力;(4)构建裸鼠皮下移植瘤(HUCCT1细胞)及尾静脉转移模型,评估HMGA1对体内肿瘤生长和转移的影响。
结果:(1)TCGA/GEO数据显示HMGA1在iCCA中高表达;(2)临床样本中HMGA1 mRNA和蛋白水平显著高于癌旁组织(P<0.001);(3)敲减HMGA1抑制iCCA细胞增殖、迁移及侵袭(n=3,P<0.01),过表达则促进上述表型;(4)裸鼠模型中,HMGA1敲减组肿瘤体积(P<0.001)、重量(P<0.01)及肝转移灶(P<0.001)均显著减少。
产品关联:qPCR使用TOYOBO的反转录试剂盒;WB使用Beyotime的RIPA裂解液、Solarbio的磷酸酶抑制剂;shRNA载体为GenePharma的LV-5;动物模型采用Vital River的5周龄雌性BALB/c裸鼠。
3.2 HMGA1调控CCND1的机制研究
实验目的:探究HMGA1促进iCCA进展的分子机制。
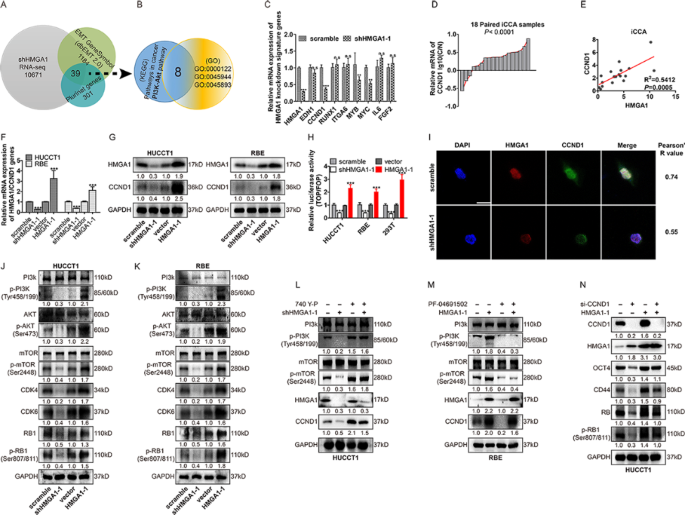
方法:(1)对HMGA1敲减的HUCCT1细胞进行RNA-seq,筛选差异基因;(2)通过KEGG(癌症通路、PI3K/Akt通路)、GO(细胞周期调控)富集分析,结合TCGA/GEO验证,确定CCND1为关键靶基因;(3)用qPCR、WB验证HMGA1对CCND1表达的调控;(4)双荧光素酶报告基因实验检测HMGA1对CCND1启动子活性的影响;(5)免疫荧光检测HMGA1与CCND1的细胞内共定位;(6)WB检测PI3K/Akt/mTOR通路分子(PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR)的磷酸化水平;(7)用PI3K激动剂(740 Y-P)、抑制剂(PF-04691502)验证通路对CCND1的调控作用。
结果:(1)RNA-seq筛选出39个差异基因,KEGG/GO富集提示CCND1为HMGA1的关键靶基因;(2)HMGA1敲减显著降低CCND1 mRNA和蛋白水平(n=3,P<0.01),过表达则升高;(3)双荧光素酶实验显示HMGA1可增强CCND1启动子活性(P<0.001);(4)免疫荧光显示HMGA1与CCND1在细胞核内共定位;(5)HMGA1过表达显著增加PI3K/Akt/mTOR通路分子的磷酸化水平(P<0.01);(6)PI3K激动剂可逆转HMGA1敲减对CCND1的抑制作用,而抑制剂则增强该作用。
产品关联:双荧光素酶报告基因试剂盒为Promega产品;PI3K激动剂740 Y-P、抑制剂PF-04691502未提及具体品牌。
3.3 CDK4/6抑制剂单药疗效评估
实验目的:评估CDK4/6抑制剂palbociclib对iCCA的单药疗效及耐药机制。
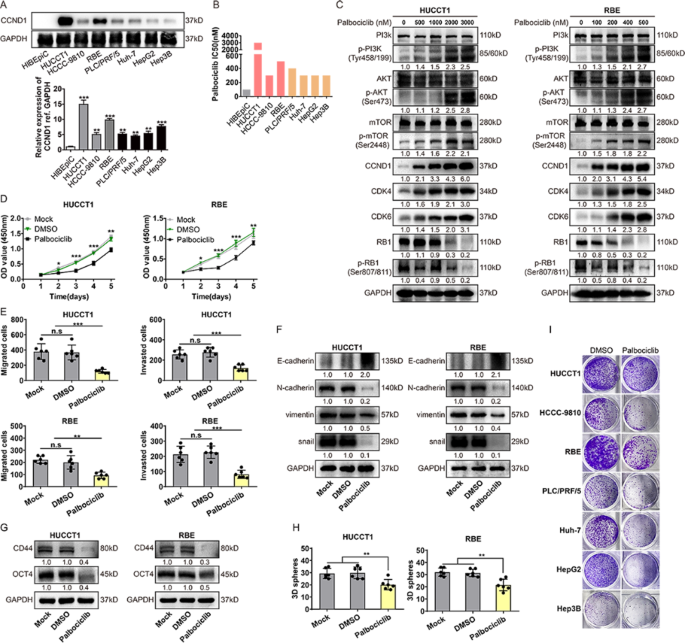
方法:(1)通过DepMap数据库分析iCCA细胞中CCND1/CDK4/CDK6的依赖性;(2)用CCK-8法检测HUCCT1、RBE等iCCA细胞对palbociclib的半数抑制浓度(IC50);(3)WB检测palbociclib对细胞周期蛋白(CCND1、CDK4、CDK6、RB、p-RB)及PI3K通路的影响;(4)通过克隆形成、Transwell实验评估palbociclib对长期增殖及迁移的影响。
结果:(1)DepMap数据显示CCND1与CDK4/6依赖性正相关;(2)iCCA细胞对palbociclib的IC50为100 nM~3 μM;(3)palbociclib短期(3天内)可抑制p-RB及RB水平(P<0.01),但长期(9天)会激活PI3K通路,上调CCND1、CDK4/6表达(P<0.05);(4)长期处理后,iCCA细胞出现增殖反弹及迁移能力恢复。
产品关联:CCK-8试剂盒为Dojindo产品;palbociclib未提及具体品牌。
3.4 PI3K/mTOR抑制剂单药疗效评估
实验目的:评估PI3K/mTOR抑制剂PF-04691502对iCCA的单药疗效。
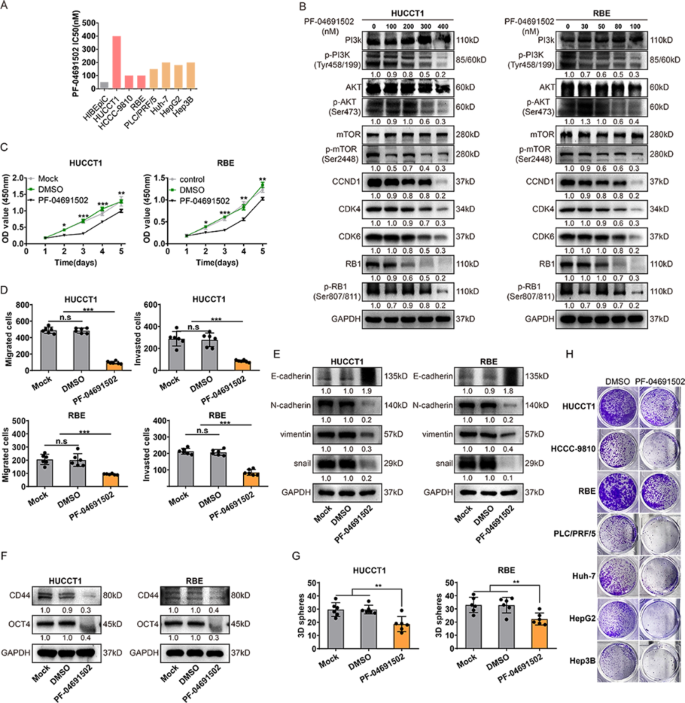
方法:(1)通过DepMap数据库分析CCND1表达与PF-04691502敏感性的相关性;(2)用CCK-8法检测iCCA细胞对PF-04691502的IC50;(3)WB检测PF-04691502对PI3K通路(p-PI3K、p-Akt、p-mTOR)及细胞周期蛋白(CCND1、CDK4、CDK6)的影响;(4)通过克隆形成、Transwell实验评估长期疗效。
结果:(1)CCND1高表达的iCCA细胞对PF-04691502更敏感(R²=0.147,P=0.0055);(2)iCCA细胞对PF-04691502的IC50与palbociclib呈正相关;(3)PF-04691502抑制PI3K通路激活(P<0.01),下调CCND1、CDK4/6表达(P<0.05);(4)短期(3天)抑制增殖、迁移,但长期(9天)疗效减弱。
产品关联:PF-04691502未提及具体品牌。
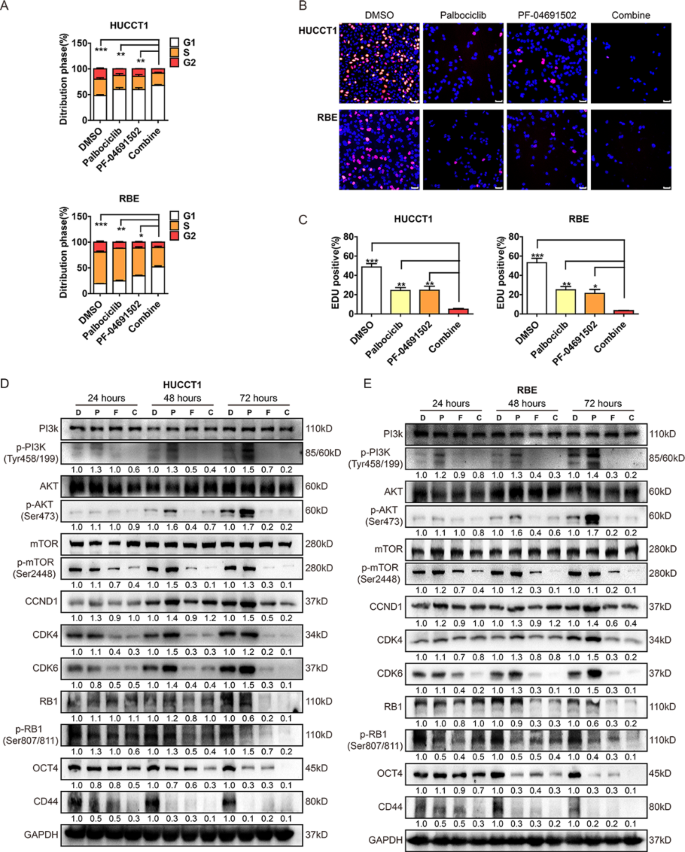
3.5 联合治疗的体内外协同作用验证
实验目的:验证palbociclib与PF-04691502联合治疗的协同疗效及机制。
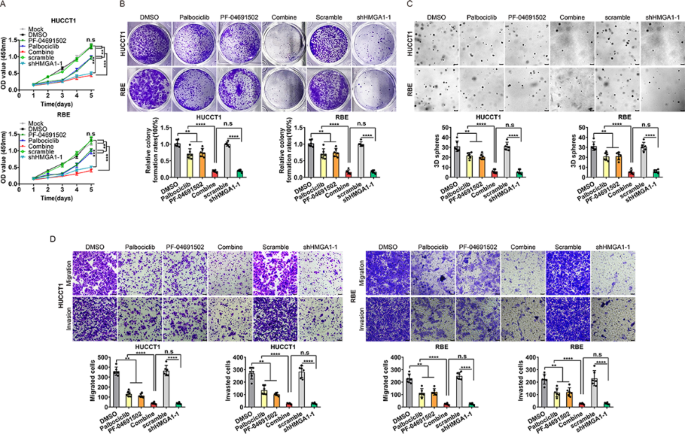
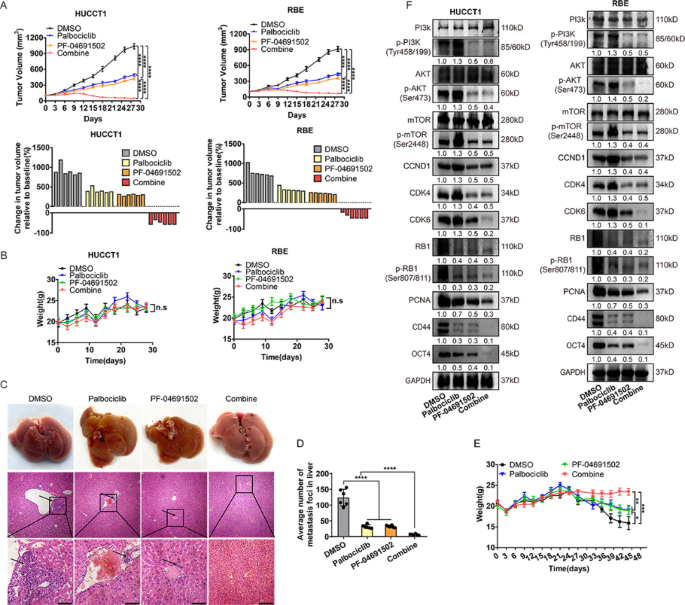
方法:(1)体外实验:iCCA细胞经单药或联合治疗后,通过CCK-8、克隆形成、Transwell实验检测增殖、克隆形成及迁移能力;流式细胞术分析细胞周期分布;WB检测PI3K通路、细胞周期(RB、p-RB)及干细胞标志物(OCT4、CD44)的表达。(2)体内实验:构建裸鼠皮下移植瘤(HUCCT1细胞)及尾静脉转移模型,评估联合治疗对肿瘤生长、转移及体重的影响;WB检测肿瘤组织中相关蛋白的表达。
结果:(1)联合治疗比单药更显著抑制细胞增殖(P<0.001)、克隆形成(P<0.01)及迁移(P<0.001),并诱导更明显的G1/S期阻滞(P<0.001);(2)WB显示联合治疗更有效抑制PI3K通路激活(p-PI3K、p-Akt、p-mTOR降低,P<0.01)、细胞周期蛋白(RB、p-RB降低,P<0.01)及干细胞标志物(OCT4、CD44降低,P<0.01);(3)裸鼠模型中,联合治疗组肿瘤体积(P<0.001)、重量(P<0.01)及肝转移灶(P<0.001)显著减少,且无明显体重下降;(4)肿瘤组织WB显示,联合治疗组RB、p-RB、PCNA及干细胞标志物表达显著降低(P<0.01)。
产品关联:流式细胞术使用Beckman Coulter的仪器;EdU试剂盒为BeyoClick的C0075S;免疫荧光使用Alexa Fluor的二抗。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker为HMGA1(结构转录因子),其筛选验证逻辑遵循“数据库挖掘→临床样本验证→细胞功能验证→动物模型验证”的完整链条:首先通过TCGA/GEO数据库筛选出iCCA中高表达的HMGA1;随后通过临床样本qPCR、WB验证其表达特征;再通过细胞实验(敲减/过表达)明确其对肿瘤进展的调控作用;最后通过动物模型证实其体内促癌功能。
研究过程详述
HMGA1的来源包括iCCA临床组织、iCCA细胞系(HUCCT1、RBE)及裸鼠肿瘤组织;验证方法涵盖:(1)数据库分析(TCGA/GEO);(2)临床样本检测(qPCR、WB);(3)细胞实验(敲减/过表达、功能实验);(4)动物实验(移植瘤、转移模型);(5)机制研究(RNA-seq、双荧光素酶报告基因、免疫荧光、WB)。
特异性与敏感性:(1)TCGA/GEO数据显示HMGA1在iCCA中的表达显著高于正常肝组织(P<0.001);(2)临床样本中HMGA1与CCND1表达呈强正相关(Spearman相关分析,P<0.01);(3)细胞实验中,HMGA1敲减特异性抑制iCCA细胞的增殖、迁移(n=3,P<0.01),对正常胆管上皮细胞(HIBEpiC)无显著影响;(4)动物模型中,HMGA1敲减显著抑制肿瘤生长(n=6,P<0.001)及转移(P<0.001)。
核心成果提炼
(1)功能关联:HMGA1是iCCA的不良预后Biomarker,其高表达与肿瘤增殖、迁移、EMT及干细胞性正相关;(2)机制创新:首次发现HMGA1通过“促进CCND1转录+激活PI3K/Akt/mTOR通路”双机制驱动iCCA进展;(3)治疗价值:HMGA1高表达的iCCA对CDK4/6与PI3K/mTOR联合抑制更敏感,联合治疗可协同抑制肿瘤进展;(4)统计结果:临床样本中HMGA1 mRNA水平是iCCA患者预后的独立危险因素(文献未明确HR值,但提及与不良预后相关);细胞实验中敲减HMGA1使增殖率降低约40%(n=3,P<0.01);裸鼠模型中联合治疗使肿瘤体积减少约60%(n=6,P<0.001)。
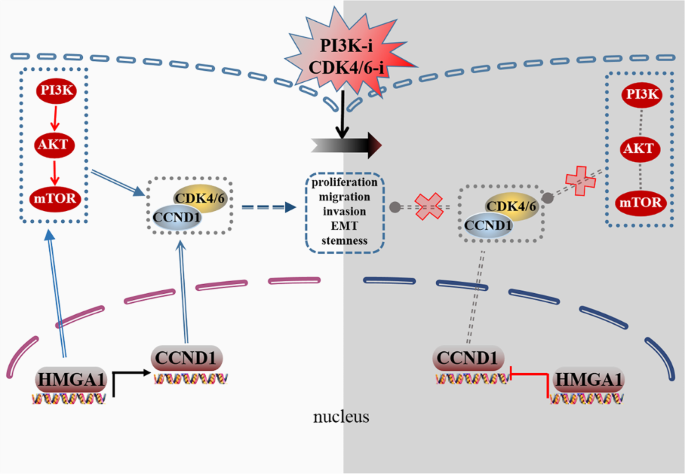
本研究通过多层面实验揭示了HMGA1在iCCA中的关键作用及联合治疗的潜力,为iCCA的精准靶向治疗提供了重要理论依据。
