1. 领域背景与文献引入
文献英文标题:NKX2.2, PDX-1 and CDX-2 as potential biomarkers to differentiate well-differentiated neuroendocrine tumors;发表期刊:Biomarker Research;影响因子:未公开;研究领域:高分化神经内分泌肿瘤(well-differentiated neuroendocrine tumor, NET)部位特异性生物标志物。
高分化神经内分泌肿瘤是起源于神经内分泌细胞的恶性肿瘤,最常见于胃肠道(gastrointestinal, GI)、胰腺和肺,占所有NET的80%以上。临床中,约19%的患者初诊时即以未知原发灶的肝转移为表现,其治疗策略(如手术切除、靶向治疗)和预后(如5年生存率:GI NET为60%-80%,胰腺NET为50%-70%,肺NET为70%-90%)高度依赖原发灶的准确定位。然而,基于形态学(如HE染色)的传统诊断难以区分未知原发灶的NET——例如,GI和胰腺NET的形态均为“巢状或小梁状生长”,肺NET的“器官样结构”也易与GI NET混淆。尽管现有研究已探索了CDX-2(肠特异性)、PAX-8(胰腺特异性)、ISL-1(胰腺特异性)等生物标志物,但这些标志物的敏感性和特异性差异较大:CDX-2对小肠和阑尾NET的敏感性可达80%以上,但对直肠和胰腺NET的敏感性不足50%;PAX-8和ISL-1在胰腺NET中的阳性率仅为60%-70%,且易与甲状腺NET交叉反应。因此,寻找能有效区分GI、胰腺和肺NET的高敏感性、高特异性生物标志物,仍是当前领域未解决的核心问题。
针对这一挑战,本研究聚焦于与神经内分泌细胞发育密切相关的转录因子(NKX2.2、PDX-1、CDX-2、PTF1A),通过组织微阵列(tissue microarray, TMA)和免疫组化(immunohistochemistry, IHC)技术,系统分析其在109例原发GI、胰腺和肺NET中的表达模式,旨在明确这些转录因子作为NET部位特异性生物标志物的潜力,为未知原发灶NET的临床诊断提供新的工具。
2. 文献综述解析
作者在文献综述中,将现有NET生物标志物研究分为三类:
第一类是肠特异性标志物(如CDX-2):CDX-2是调控肠上皮分化的核心转录因子,对小肠和阑尾NET的敏感性可达80%以上,但对结肠、直肠和胰腺NET的敏感性不足50%,无法区分GI内部的NET亚型;
第二类是胰腺特异性标志物(如PAX-8、ISL-1):PAX-8和ISL-1均参与胰腺胰岛细胞的发育,虽能区分胰腺与肺NET,但在胰腺NET中的阳性率仅为60%-70%,且易与甲状腺NET交叉反应;
第三类是非特异性标志物(如突触素、嗜铬粒蛋白A):虽广泛表达于NET(敏感性>90%),但无法区分原发部位,仅用于“神经内分泌分化”的确认。
作者指出,现有研究的局限性在于:(1)单一标志物的诊断效能不足——例如,CDX-2无法诊断直肠NET,PAX-8无法诊断低分化胰腺NET;(2)缺乏对多个关键转录因子的同时分析——例如,NKX2.2作为调控胰腺β细胞和肠内分泌细胞分化的核心转录因子,其在NET中的表达模式尚未被系统研究;PDX-1(胰腺和十二指肠发育调控因子)和CDX-2的组合应用也未在大样本中验证。
本研究的创新点在于:(1)首次系统验证了NKX2.2在GI和胰腺NET中的高敏感性(84%);(2)同时分析了PDX-1、CDX-2与NKX2.2的组合表达,明确了其对GI内部NET亚型的区分价值;(3)纳入了肺NET作为“阴性对照”,验证了标志物的部位特异性。
3. 研究思路总结与详细解析
本研究的目标是“明确NKX2.2、PDX-1、CDX-2、PTF1A在GI、胰腺和肺NET中的表达模式,筛选能区分不同部位NET的生物标志物panel”;核心科学问题是“这些转录因子能否作为NET部位特异性生物标志物”;技术路线为“回顾性收集样本→构建TMA/全组织切片→IHC检测标志物表达→统计分析表达差异→验证标志物特异性”。
3.1 组织样本收集与TMA构建
实验目的:获取标准化的NET组织样本,用于后续IHC检测。
方法细节:回顾性收集2010年1月至2015年12月期间,美国佛蒙特大学医学中心存档的109例原发高分化NET样本,其中GI来源81例(胃12例、十二指肠8例、空肠9例、回肠24例、阑尾10例、结肠10例、直肠8例)、胰腺来源17例、肺来源11例(7例典型类癌、4例非典型类癌)。对于手术切除样本,采用2mm芯的TMA技术构建组织芯片(每例样本取2个芯,覆盖肿瘤核心区和边缘区);对于活检样本(如内镜下活检),直接制备2-3层全组织切片。所有样本均经两位病理学家复阅,确认诊断符合2015年WHO NET分类标准(G1:核分裂象<2/10HPF,Ki-67<3%;G2:核分裂象2-20/10HPF,Ki-673%-20%)。
结果解读:成功构建了包含81例GI、17例胰腺NET的TMA,及11例肺NET的全组织切片,样本覆盖了NET的三大常见部位,为后续IHC检测提供了标准化材料。
实验所用关键产品:TMA构建工具为Beecher Instruments的2mm芯打孔器;IHC抗体包括PDX-1(Abcam,克隆2A12,1:100稀释)、PTF1A(Abcam,克隆1A2,1:200稀释)、NKX2.2(Abcam,克隆NX2/294,1:100稀释)、CDX-2(Leica Biosystems,克隆EP25)。
3.2 免疫组化(IHC)检测与验证
实验目的:检测NKX2.2、PDX-1、CDX-2、PTF1A在NET中的表达水平,并验证抗体的特异性。
方法细节:所有IHC检测均在Leica BOND-III自动化染色仪上完成。抗体验证策略:PDX-1、PTF1A、NKX2.2通过正常胰腺组织验证(预期在胰岛细胞表达,腺泡和导管细胞阴性);CDX-2通过正常肠组织验证(预期在肠上皮细胞核表达)。抗原修复条件:CDX-2使用H2缓冲液(Leica)修复10分钟;NKX2.2和PTF1A使用H1缓冲液(Leica)修复30分钟;PDX-1使用H1缓冲液修复10分钟。结果判断标准:肿瘤细胞核染色比例>5%定义为阳性(因NET的“神经内分泌分化”通常为弥漫性,局灶阳性无诊断价值)。
结果解读:IHC结果显示,NKX2.2、PDX-1、CDX-2的表达具有部位特异性——GI和胰腺NET中,NKX2.2阳性率为84%(n=98),PDX-1为14%(n=98),CDX-2为53%(n=98);肺NET中,三者均为阴性(n=11);PTF1A在所有NET和正常组织中均呈阳性(提示其为“泛神经内分泌标志物”,无部位特异性)。为验证TMA结果的可靠性,作者对8例GI和胰腺NET的全组织切片重复IHC,结果与TMA完全一致(弥漫阳性或完全阴性),排除了TMA“取样偏差”的影响。
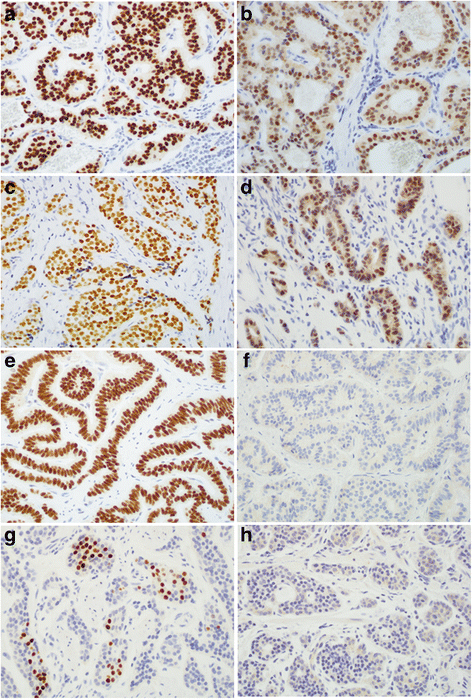
(图2:不同部位NET的IHC结果示例——十二指肠NET中NKX2.2弥漫阳性,胃NET中NKX2.2阴性;阑尾NET中PDX-1阳性,结肠NET中PDX-1阴性)
3.3 标志物表达模式与部位特异性分析
实验目的:分析NKX2.2、PDX-1、CDX-2在不同部位NET中的表达差异,明确其诊断价值。
方法细节:统计GI各段(胃、十二指肠、空肠、回肠、阑尾、结肠、直肠)、胰腺和肺NET中,各标志物的阳性率,并计算敏感性(95%置信区间,95%CI)——敏感性=阳性病例数/总病例数,反映标志物对该部位NET的“检出能力”。
结果解读:
- GI NET:NKX2.2的阳性率从高到低依次为:阑尾(100%)、回肠(92%)、空肠(89%)、十二指肠(88%)、结肠(75%)、胃(17%)、直肠(67%);PDX-1主要表达于十二指肠(75%)、阑尾(32%)、空肠(20%)和回肠(8%),胃、结肠、直肠NET均为阴性;CDX-2主要表达于阑尾(100%)、回肠(96%)、空肠(94%)、十二指肠(88%)、结肠(50%),直肠和胃NET均为阴性。
- 胰腺NET:NKX2.2阳性率为71%(n=17),PDX-1仅1例阳性(6%),CDX-2阳性率为11%(n=17)。
- 肺NET:所有标志物均为阴性(n=11)。
统计学分析显示,NKX2.2、PDX-1、CDX-2的表达与NET分级(G1/G2)无显著相关性(P>0.05),说明其诊断价值不受肿瘤分化程度影响。
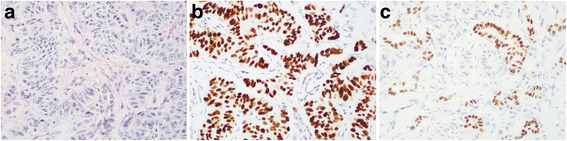
(图3:胰腺NET的IHC结果——NKX2.2弥漫阳性,CDX-2局灶阳性,PDX-1阴性)
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心Biomarker为NKX2.2、PDX-1、CDX-2,其筛选逻辑基于“转录因子与神经内分泌细胞发育的相关性”:
- NKX2.2:调控胰腺β细胞和肠内分泌细胞的分化(敲除NKX2.2的小鼠,胰腺β细胞完全缺失,肠内分泌细胞数量减少50%);
- PDX-1:调控胰腺和十二指肠的发育(敲除PDX-1的小鼠,胰腺和十二指肠完全缺失);
- CDX-2:调控肠上皮的分化(敲除CDX-2的小鼠,肠上皮无法形成“绒毛-隐窝”结构)。
验证逻辑为“TMA+IHC大样本验证→全组织切片确认→部位特异性分析”,确保结果的可靠性和临床适用性。
研究过程与数据
Biomarker的来源为“临床存档的福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded, FFPE)NET样本”,覆盖GI、胰腺和肺三大常见部位(n=109)。验证方法为免疫组化(IHC),结果判断标准为“肿瘤细胞核染色>5%”(符合临床病理的常规诊断标准)。
敏感性与特异性数据:
- NKX2.2:在GI和胰腺NET中的敏感性为84%(95%CI:75%-90%,n=98),在肺NET中的特异性为100%(n=11);
- PDX-1:在小肠和阑尾NET中的敏感性为32%-75%(n=32),在胃、结肠、直肠NET中的特异性为100%(n=66);
- CDX-2:在小肠和阑尾NET中的敏感性为88%-100%(n=32),在直肠NET中的特异性为100%(n=8)。
核心成果与临床价值
本研究的核心成果可总结为三点:
1. NKX2.2是GI和胰腺NET的“泛特异性标志物”:其敏感性(84%)显著高于现有胰腺标志物(如PAX-8的60%-70%),且对肺NET完全阴性,可有效区分GI/胰腺NET与肺NET——例如,若转移灶中NKX2.2阳性,提示原发灶为GI或胰腺;若阴性,则提示肺NET(需结合TTF-1验证)。
2. PDX-1和CDX-2是小肠和阑尾NET的“亚型特异性标志物”:PDX-1主要表达于十二指肠(75%)和阑尾(32%)NET,CDX-2主要表达于阑尾(100%)和回肠(96%)NET,二者组合可辅助区分GI内部的NET亚型——例如,若NKX2.2阳性+PDX-1阳性,提示原发灶为十二指肠NET;若NKX2.2阳性+CDX-2阳性,提示原发灶为阑尾或回肠NET。
3. 组合标志物panel的诊断价值:作者提出,“NKX2.2+PDX-1+CDX-2”的组合可显著提高NET部位诊断的准确性(图4)——例如,对于未知原发灶的NET转移灶,先测NKX2.2:若阳性,再测PDX-1和CDX-2,区分小肠/阑尾NET与胰腺/直肠NET;若阴性,测TTF-1(肺NET的特异性标志物),确认肺NET。

(图4:组合标志物的临床诊断流程——先测NKX2.2,阳性则测PDX-1和CDX-2,阴性则测TTF-1)
结论
本研究通过系统分析,明确了NKX2.2、PDX-1、CDX-2作为NET部位特异性生物标志物的潜力,为未知原发灶NET的临床诊断提供了新的工具。未来研究可进一步扩大样本量(如增加肺NET样本),并验证该panel在转移灶中的诊断效能,推动其向临床转化。
