1. 领域背景与文献引入
文献英文标题:A machine learning-based model to predict POD24 in follicular lymphoma: a study by the Chinese workshop on follicular lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:滤泡性淋巴瘤(FL)的24个月内疾病进展(POD24)预测模型开发与验证。
滤泡性淋巴瘤(FL)是最常见的惰性非霍奇金淋巴瘤,中位总生存期(OS)超过10-12年,但临床异质性极大——约20%患者在初治后24个月内出现疾病进展(POD24),这类患者的5年OS率仅29%-54%,显著低于无POD24的患者(约90%)。因此,早期识别POD24高风险患者是优化治疗决策的核心:高风险患者需更强化的治疗(如奥滨尤妥珠单抗为基础的免疫化疗)以延缓进展,低风险患者则可采用标准治疗避免过度干预。
现有FL预后模型存在明显局限性:传统临床模型(如FLIPI、FLIPI-2)虽依赖易获取的指标,但预测POD24的假阳性率高达44%;整合基因特征的模型(如m7-FLIPI)虽准确性更高,却需基因检测,临床实用性受限;且现有模型多基于传统统计方法(logistic/Cox回归),对非线性数据的处理能力有限。此外,现有模型缺乏针对中国FL患者的验证——中国FL患者的基线特征(如年龄、疾病分期)与西方人群差异显著,亟需本土化的预测工具。
本研究针对上述空白,利用中国多中心1938例FL1-3a患者队列,通过XGBoost机器学习算法开发FLIPI-C模型,旨在提供更准确、实用的POD24预测工具,并通过内部及外部(GALLIUM队列)验证确认其性能。
2. 文献综述解析
作者将现有FL预后模型分为三类,从准确性、实用性、种族适用性三个维度评述其优缺点:
- 传统临床模型(FLIPI、FLIPI-2、PRIMA-PI):优势是依赖临床易获取的指标(如LDH、Hb),实用性强;但预测POD24的准确性不足(FLIPI的AUC仅约0.65),无法满足精准需求。
- 基因整合模型(m7-FLIPI、POD24-PI):优势是通过纳入基因突变(如EZH2、ARID1A)提高了准确性(AUC约0.75-0.8);但需基因检测,基层临床难以普及。
- 机器学习模型:优势是能处理非线性数据,潜在准确性更高;但目前在FL中的应用较少,且缺乏中国人群的验证。
作者进一步指出现有研究的核心不足:① 传统模型无法精准预测POD24;② 基因模型的临床实用性差;③ 现有模型未覆盖中国FL患者;④ 传统统计方法对非线性数据的处理能力有限。
本研究的创新价值在于:① 针对中国FL患者队列开发模型,填补种族适用性空白;② 采用XGBoost算法提升非线性数据处理能力;③ 整合临床易获取的多维度指标(血液、影像、临床特征),兼顾准确性与实用性;④ 在内部及外部队列全面验证模型性能,确保普适性。
3. 研究思路总结与详细解析
整体框架
研究目标:开发并验证基于机器学习的FL POD24预测模型FLIPI-C;核心科学问题:如何利用临床易获取的指标准确预测FL患者的POD24风险;技术路线:多中心队列招募→数据拆分(训练:验证=2:1)→算法筛选(XGBoost最优)→特征选择(SHAP+logistic+Cox回归)→模型构建(评分系统)→内部/外部验证→性能比较→治疗指导价值分析。
3.1 研究队列建立与数据拆分
实验目的:获取足够样本用于模型开发与验证。
方法细节:纳入中国17家中心2000-2020年新诊断的FL1-3a患者2243例,排除信息不全(n=292)及失访(n=13)患者,最终1938例;按2:1随机分为训练集(1292例)和内部验证集(646例);外部验证采用GALLIUM队列(1115例,最终纳入944例有完整FLIPI-C数据的患者)。
结果解读:中国队列与GALLIUM队列的基线特征差异显著(中国队列中位年龄51岁,GALLIUM队列59岁;GALLIUM队列的LDH、β2-MG升高比例更高),这种差异有助于验证模型的普适性。
3.2 机器学习算法选择与特征筛选
实验目的:选择最优算法并筛选与POD24相关的关键特征。
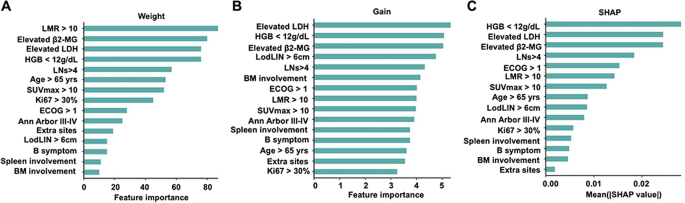
方法细节:比较4种二进制分类算法(DecisionTree、RandomForest、RidgeClassifier、XGBoost)的POD24预测性能(通过混淆矩阵评估);将15个基线临床特征输入XGBoost,通过Weight、Gain、SHAP分析评估特征重要性;结合logistic回归(验证POD24独立风险因子)和Cox回归(验证PFS/OS预测因子)确定最终特征。
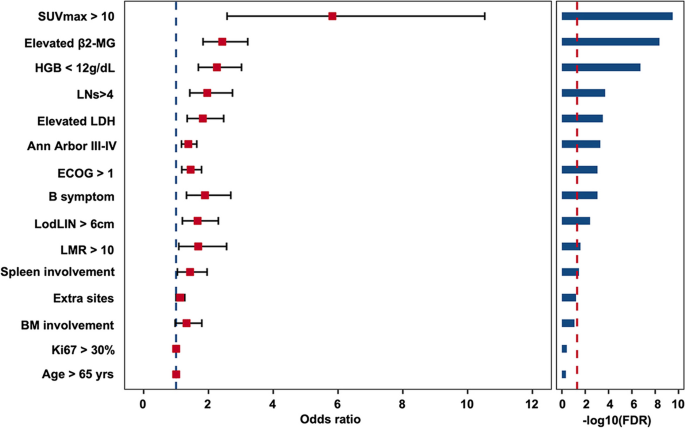
结果解读:XGBoost算法的性能最佳(Supplementary Fig.1);最终筛选出6个关键特征:淋巴细胞/单核细胞比(LMR)>10、LDH>ULN、Hb降低、β2-MG升高、SUVmax>10、淋巴结受累数>4。这些特征均与POD24显著相关(logistic回归的OR值均>1.5,P<0.05)。
3.3 FLIPI-C模型构建
实验目的:将关键特征转化为可临床应用的评分系统。
方法细节:根据XGBoost模型的特征重要性赋值——LMR赋值2分,其他5个特征各赋值1分,总分为0-7分;通过ROC曲线的Youden指数确定最优cutoff值(3分),将患者分为低风险组(0-3分)和高风险组(4-7分)。
结果解读:模型在训练集的5折交叉验证准确性为80.6%,10折为80.8%,显示良好的稳定性。
3.4 模型验证与性能比较
实验目的:验证FLIPI-C的准确性,并与现有模型(FLIPI、FLIPI-2、PRIMA-PI、FLEX)比较。
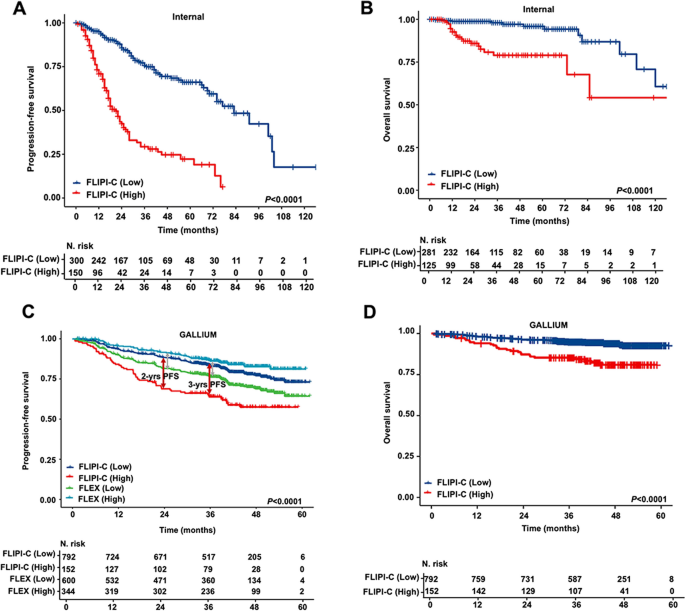
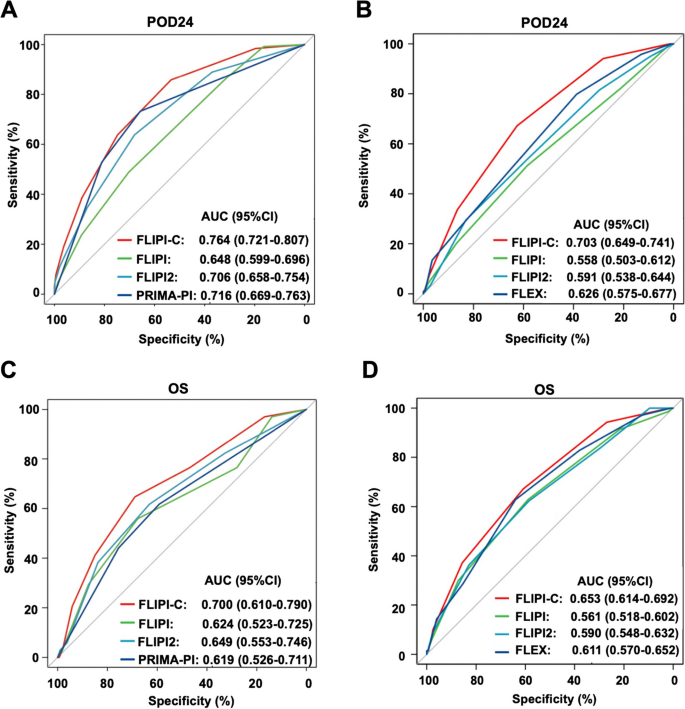
方法细节:内部验证(中国多中心验证集)和外部验证(GALLIUM队列)通过ROC曲线的AUC评估POD24及3年OS的预测准确性;通过决策曲线分析(DCA)评估临床净获益;通过Kaplan-Meier生存分析比较低/高风险组的PFS和OS。
结果解读:
- 准确性:内部验证集POD24的AUC为0.764(95%CI 0.72-0.81),3年OS的AUC为0.700;外部GALLIUM队列POD24的AUC为0.703(95%CI 0.64-0.74),均显著高于现有模型(FLIPI的AUC约0.65)。
- 临床净获益:DCA显示,FLIPI-C的净获益在所有风险阈值下均高于现有模型(如在20%风险阈值下,FLIPI-C的净获益为0.25,FLIPI仅为0.15)。
- 生存分层:低风险组的2年PFS(内部85.7% vs 高风险42.4%,P<0.0001;外部88.4% vs 63.8%,P<0.0001)和5年OS(内部95.8% vs 78.9%,P<0.0001;外部92.8% vs 81.0%,P<0.0001)均显著高于高风险组。
3.5 一线治疗对FLIPI-C分层患者的疗效分析
实验目的:探讨FLIPI-C对治疗决策的指导价值。
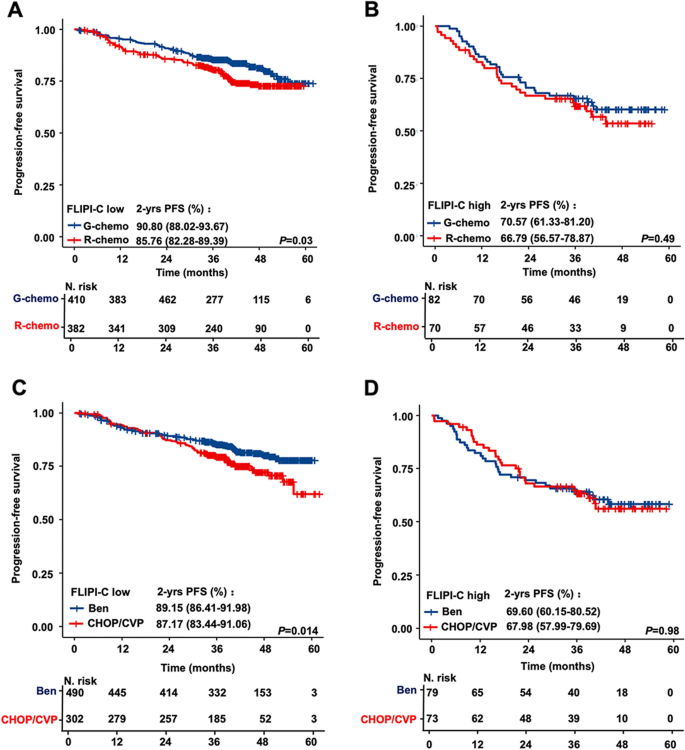
方法细节:在GALLIUM队列中,分析不同一线治疗(R-chemo vs G-chemo;B-R/G vs CHOP/CVP+R/G)对低/高风险组患者PFS的影响。
结果解读:G-chemo在低风险组的2年PFS(90.8% vs R-chemo的85.7%,P=0.03)显著优于R-chemo,但高风险组无差异(70.6% vs 66.8%,P=0.49);苯达莫司汀联合R/G在低风险组的2年PFS(89.1% vs CHOP/CVP+R/G的87.1%,P=0.014)优于后者,高风险组无差异。这提示FLIPI-C可指导治疗选择——低风险患者从高效免疫化疗中获益,高风险患者需更强化的治疗(如CAR-T)。
4. Biomarker研究及发现成果解析
Biomarker定位
FLIPI-C的Biomarker包括6个临床易获取的指标:淋巴细胞/单核细胞比(LMR)>10、乳酸脱氢酶(LDH)>ULN、血红蛋白(Hb)降低、β2微球蛋白(β2-MG)升高、最大标准化摄取值(SUVmax)>10、淋巴结受累数>4。
筛选逻辑:机器学习初筛+多维度验证——先通过XGBoost从15个特征中初步筛选,再结合SHAP分析(特征对模型的贡献度)、logistic回归(POD24独立风险因子)、Cox回归(PFS/OS预测因子)确定最终Biomarker。
验证逻辑:训练集构建→内部验证(中国多中心)→外部验证(GALLIUM队列),确保Biomarker的稳定性和普适性。
研究过程详述
Biomarker的来源是患者初诊时的基线临床数据:LMR、LDH、Hb、β2-MG来自血液检测;SUVmax来自PET-CT影像学检查;淋巴结受累数来自临床及影像学评估。
验证方法:① 模型构建时,通过训练集的XGBoost、logistic和Cox回归验证Biomarker与POD24的相关性;② 内部验证集通过ROC曲线、生存分析验证Biomarker组合的预测性能;③ 外部GALLIUM队列通过相同方法验证普适性。
特异性与敏感性:内部验证集POD24预测的AUC为0.764(95%CI 0.72-0.81),说明模型整体预测能力良好;cutoff值3分时,通过Youden指数确定的敏感性和特异性为最高(文献未明确具体数值,但提到“该cutoff值显示最高的敏感性和特异性”)。
核心成果提炼
- 功能关联:6个Biomarker组合成的FLIPI-C模型,能有效预测FL患者的POD24风险(AUC更高)和生存结局(低风险组vs高风险组的生存差异显著)。
- 创新性:首次针对中国FL患者开发机器学习POD24预测模型,整合临床易获取的多维度Biomarker,兼顾准确性与实用性。
- 临床价值:模型的临床净获益高于现有模型,能指导治疗决策——低风险患者可从G-chemo中获益,高风险患者需更强化的治疗。
统计学结果:内部验证集低风险组vs高风险组的2年PFS(85.7% vs 42.4%,P<0.0001)、5年OS(95.8% vs 78.9%,P<0.0001);外部队列2年PFS(88.4% vs 63.8%,P<0.0001)、5年OS(92.8% vs 81.0%,P<0.0001),差异均具有统计学意义。
综上,本研究开发的FLIPI-C模型为FL患者的POD24预测提供了更准确、实用的工具,有望推动FL的个性化治疗,尤其适用于中国及类似种族背景的FL患者。
