1. 领域背景与文献引入
文献英文标题:Oncogenic alterations in advanced NSCLC: a molecular super-highway;发表期刊:Biomarker Research;影响因子:未公开;研究领域:晚期非小细胞肺癌致癌驱动基因研究。
肺癌是全球发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)占80%-85%。过去二十年,NSCLC的分类从单纯组织学(鳞癌、腺癌、大细胞癌)演变为基于致癌驱动基因的分子亚型(如EGFR、ALK、KRAS等),精准医学已成为晚期NSCLC的核心治疗策略。2004年EGFR突变的发现开启了靶向治疗时代,随后ALK、ROS1、KRAS G12C等靶点的突破推动了疗效的跨越式提升——驱动基因阳性患者的中位生存期从化疗时代的1年延长至靶向治疗时代的3-5年。然而,当前领域仍面临诸多挑战:① 耐药机制复杂(如EGFR T790M/C797S突变、MET扩增);② 罕见驱动基因(如RET、NTRK、NRG1)的诊断和治疗手段有限;③ 部分靶点(如PI3K、FGFR)的临床意义尚不明确。
本文聚焦晚期NSCLC的致癌驱动基因景观,系统总结了各驱动基因的分子机制、临床特征、靶向治疗策略及耐药机制,旨在为临床医生提供全面的分子诊疗参考,同时探讨精准医学的未来方向。
2. 文献综述解析
作者以致癌驱动基因类型为核心分类维度(EGFR、ALK、KRAS、ROS1、BRAF、RET、MET、NTRK、NRG1等),对现有研究进行结构化评述:
现有研究的关键结论与局限
① 驱动基因的人群异质性:EGFR突变在亚裔肺腺癌患者中占50%以上,西方仅15%;KRAS G12C在西方NSCLC中占13%,亚裔罕见;ALK/ROS1重排主要见于年轻、非吸烟患者。② 靶向治疗的疗效突破:三代EGFR TKI奥希替尼的中位PFS达18.9个月(显著优于一代TKI的10.2个月);ALK TKI阿来替尼的5年OS率达62.5%;KRAS G12C抑制剂sotorasib的中位PFS(5.6个月)优于化疗(4.5个月)。③ 耐药机制的多样性:包括靶基因二次突变(如EGFR T790M/C797S、KRAS G13D)、旁路激活(如MET/HER2扩增)、组织学转化(如小细胞肺癌转化)。
现有研究的技术优势:NGS提高了驱动基因检测的灵敏度(可同时检测数百个基因),液体活检(ctDNA)为无法获取组织的患者提供了无创检测可能;局限性:液体活检的敏感性低于组织(如血浆NGS对EGFR突变的敏感性仅60%-65%),罕见驱动基因的临床数据多来自小样本试验,部分靶点(如PI3K、FGFR)的致癌驱动作用未明确。
本文的创新价值
相较于现有综述,本文的核心贡献在于整合最新临床证据(如奥希替尼的FLAURA trial、sotorasib的CodeBreaK 200 trial),并覆盖所有主要和罕见驱动基因(包括NRG1、FGFR等新兴靶点),同时系统分析了耐药机制的应对策略(如四代EGFR TKI、KRAS G12D抑制剂),为临床实践提供了“从检测到治疗”的完整路径。
3. 研究思路总结与详细解析
本文采用“驱动基因分类+临床证据整合”的研究框架,旨在全面呈现晚期NSCLC的分子景观。以下按关键实验环节解析:
3.1 常见驱动基因的临床特征与治疗
实验目的:总结EGFR、ALK、KRAS等常见驱动基因的人群特征及靶向治疗疗效。
方法细节:回顾多项III期临床 trial(如FLAURA trial对比奥希替尼与一代TKI、CodeBreaK 200 trial对比sotorasib与化疗)、meta分析及真实世界研究。
结果解读:① EGFR突变在亚裔、非吸烟、女性患者中高发,经典突变( exon 19缺失/21 L858R)占90%,三代TKI奥希替尼的中位PFS达18.9个月(OS 38.6个月),显著优于一代TKI(PFS 10.2个月、OS 31.8个月);② ALK重排在年轻(中位年龄52岁)、非吸烟患者中占4%,二代TKI阿来替尼的中位PFS达34.8个月,5年OS率62.5%;③ KRAS G12C在西方NSCLC中占13%,主要见于吸烟者,sotorasib的客观缓解率(ORR)达28.1%,中位PFS 5.6个月。
产品关联:文献未提及具体实验产品,领域常规使用NGS检测试剂(如Illumina NovaSeq)、靶向治疗药物(奥希替尼、阿来替尼、sotorasib)。
3.2 罕见驱动基因的诊断与治疗
实验目的:探讨RET、MET、NTRK等罕见驱动基因的临床意义。
方法细节:纳入小样本临床 trial(如RET的LIBRETTO 001 trial、MET的GEOMETRY-mono-1 trial)及全球 registry(如NRG1的eNRGy1 registry)。
结果解读:① RET重排占NSCLC的1%-2%,塞尔帕替尼的ORR达64%(经治)、85%(初治);② MET exon 14跳跃突变占NSCLC的3%-5%,卡马替尼的ORR达68%(初治);③ NTRK融合占NSCLC的0.2%-3.3%,拉罗替尼的ORR达75%(NSCLC亚组);④ NRG1融合占NSCLC的0.3%,afatinib的ORR达25%。
产品关联:文献未提及具体实验产品,领域常规使用RNA-seq检测融合基因、靶向治疗药物(塞尔帕替尼、卡马替尼、拉罗替尼)。
3.3 耐药机制与应对策略
实验目的:分析靶向治疗的耐药机制及新型药物的潜力。
方法细节:回顾耐药机制的分子研究(如EGFR T790M/C797S突变、KRAS G12C抑制剂的耐药突变)及新型药物的临床前/早期试验(如四代EGFR TKI BLU-945、KRAS G12D抑制剂 MRTX1133)。
结果解读:① EGFR TKI的耐药机制包括靶基因二次突变(T790M占50%-60%、C797S占25%)、旁路激活(MET扩增占18%);② KRAS G12C抑制剂的耐药机制包括KRAS二次突变(G13D、Q99L)、旁路激活(MET扩增);③ 新型药物如BLU-945(四代EGFR TKI)可抑制C797S突变,MRTX1133(KRAS G12D抑制剂)在临床前研究中显示出抗肿瘤活性。
产品关联:文献未提及具体实验产品,领域常规使用数字PCR检测耐药突变、新型靶向药物(BLU-945、MRTX1133)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心Biomarker为致癌驱动基因(EGFR突变、ALK重排、KRAS G12C突变等),筛选逻辑遵循“数据库筛选→组织/液体活检验证→临床 trial确认”:① 通过TCGA等数据库分析驱动基因的prevalence;② 利用NGS/ctDNA检测临床样本中的驱动基因;③ 结合随机对照试验(RCT)验证其与靶向治疗反应的关联。
研究过程详述
- 来源:肿瘤组织(手术/活检标本)、液体活检(血浆ctDNA);
- 验证方法:组织NGS(金标准)、血浆ctDNA(无创替代)、FISH(检测融合基因)、RT-PCR(检测exon 14跳跃突变);
- 特异性与敏感性:组织NGS的敏感性>90%,血浆ctDNA对EGFR突变的敏感性为60%-65%,特异性>96%;
核心成果
① 预测性Biomarker:EGFR突变阳性患者对TKI的ORR达75%,ALK重排患者对阿来替尼的ORR达82.9%;② 预后性Biomarker:EGFR突变阳性患者的OS显著长于野生型(奥希替尼组38.6个月 vs 化疗组20.2个月);③ 耐药Biomarker:EGFR T790M突变提示对三代TKI敏感,MET扩增提示对MET抑制剂敏感。
例如,EGFR exon 19缺失/21 L858R突变作为一线TKI治疗的预测Biomarker,其ORR达75%,中位PFS 10-18个月;KRAS G12C突变作为sotorasib治疗的预测Biomarker,ORR达28.1%,中位PFS 5.6个月。
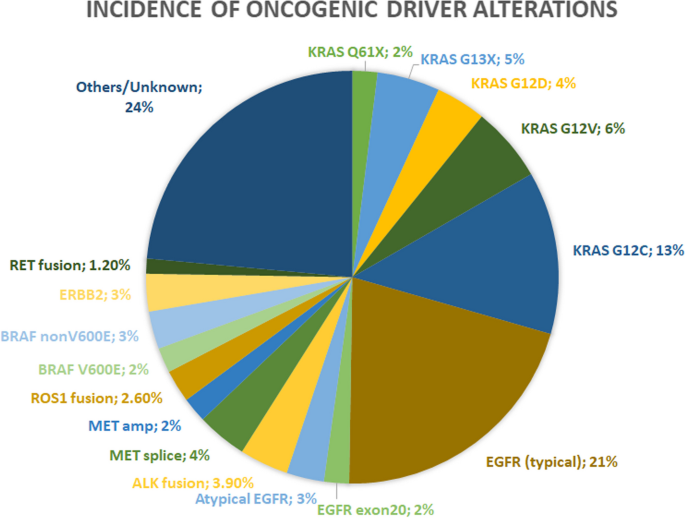
(图1:晚期肺腺癌致癌驱动基因的发生率)
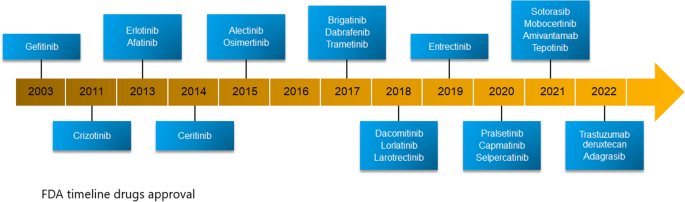
(图2:FDA批准的NSCLC靶向药物时间线)
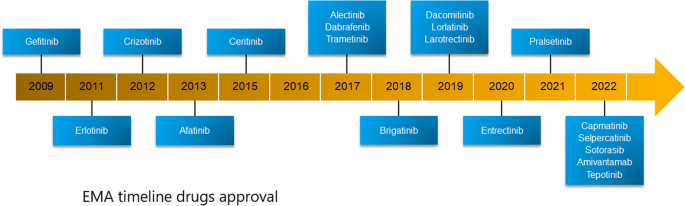
(图3:EMA批准的NSCLC靶向药物时间线)
