1. 领域背景与文献引入
文献英文标题:Lysyl oxidase expression is associated with inferior outcome and Extramedullary disease of acute myeloid leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)生物标志物与预后研究
急性髓系白血病(AML)是成人最常见的急性白血病,年发病率约为1.6/10万,其预后异质性极大——患者5年生存率仅约29%(<60岁)至10%(>60岁)。髓外病变(Extramedullary AML, EM AML)是AML的重要侵袭性特征,指白血病细胞浸润骨髓以外的组织(如淋巴结、皮肤、中枢神经系统),其临床发病率约为9%-32%(因检测方法而异)。然而,现有研究对EM AML的预后意义仍存争议:部分研究认为EM AML与不良预后相关,部分则认为无显著影响;此外,EM AML的系统筛查(如18FDG-PET/CT)未常规开展,导致其实际发病率可能被低估。
在实体瘤研究中,赖氨酸氧化酶(Lysyl oxidase, LOX)作为铜依赖性胺氧化酶,通过催化胶原蛋白和弹性蛋白的交联,参与“转移前微环境”的形成——肿瘤细胞在缺氧条件下通过HIF-1通路诱导LOX表达,分泌后经BMP-1切割活化,交联胶原蛋白形成“促转移纤维化微环境”,促进肿瘤细胞定植与转移。LOX高表达与实体瘤(如乳腺癌、肺癌)的远处转移率及不良预后密切相关。然而,LOX在AML中的表达特征、与临床特征的关联及预后价值尚未充分探讨,尤其是缺乏LOX与EM AML的关联研究。因此,本研究旨在通过大样本AML队列,分析LOX血浆表达与患者临床特征、预后及EM AML的关系,探讨其作为AML尤其是EM AML预后生物标志物的潜力。
2. 文献综述解析
文献综述的核心逻辑为“实体瘤LOX功能→AML EM病变研究现状→LOX与AML的研究空白”。作者首先综述实体瘤中LOX的功能:LOX通过交联胶原蛋白形成“促转移微环境”,其高表达与实体瘤转移及不良预后正相关;接着转向AML的EM病变研究:EM AML与单核细胞表型(FAB M5亚型)、特定细胞遗传学异常(如11q23易位、复杂核型)及NPM1突变相关,但由于缺乏系统筛查,其真实发病率和预后意义仍不明确;最后指出现有研究的局限性:①未探讨LOX与AML尤其是EM AML的关联;②EM AML的预后分层缺乏客观生物标志物;③AML患者的LOX表达特征及调控机制未被解析。
本研究的创新点在于:首次在大样本(683例)AML队列中分析LOX血浆表达与临床特征、预后及EM AML的关联;发现LOX与EM AML的交互作用对AML预后的独立影响;为EM AML这一预后异质性群体提供了新的预后分层生物标志物。
3. 研究思路总结与详细解析
本研究为前瞻性队列研究,基于AML2003临床试验的683例AML患者,核心目标是探讨LOX血浆表达与患者临床特征、预后及EM AML的关联;核心科学问题是“LOX是否可作为AML尤其是EM AML的预后生物标志物”;技术路线为“队列建立→LOX检测→临床关联分析→生存分析→EM AML亚组验证→多因素交互作用分析”,形成“检测-关联-验证”的完整闭环。
3.1 研究队列与样本收集
实验目的:建立符合条件的AML患者队列,收集初诊时的血浆样本以检测LOX水平。
方法细节:纳入2003-2009年参与AML2003前瞻性试验(NCT00180102)的17-60岁AML患者,要求患者初诊时留存外周血锂肝素血浆样本,且临床数据(细胞遗传学、分子突变、EM AML状态)完整。最终纳入683例患者(男性371例,女性312例,中位年龄46岁)。
结果:成功建立大样本AML队列,样本及临床数据均可用,为后续分析奠定基础。
产品关联:文献未提及具体采血管品牌,领域常规使用锂肝素采血管收集血浆样本。
3.2 LOX血浆水平检测与cutoff值确定
实验目的:定量检测患者血浆LOX浓度,确定用于预后分层的最优cutoff值。
方法细节:使用Amplite荧光LOX检测试剂盒(AAT Bioquest)按说明书操作:以重组人LOXL2蛋白(R&D Systems)建立标准曲线(Ex/Em 540/590 nm),以NPM1突变AML细胞系OCI/AML3(DSMZ)的上清液作为内参(评估批间差异),所有检测设3个复孔。通过最小p值法(基于Cox模型的Martingale残差分析)确定最优cutoff值。
结果:LOX浓度范围为0-2184 ng/mL(均值119.7 ng/mL),最优cutoff值为109 ng/mL(logLOX=2.0403),据此将患者分为LOX-high组(>109 ng/mL,n=272,40%)和LOX-low组(≤109 ng/mL,n=411,60%)。
产品关联:实验所用关键产品:AAT Bioquest的Amplite荧光LOX检测试剂盒、R&D Systems的重组人LOXL2蛋白、DSMZ的OCI/AML3细胞系、Berthold Technologies的荧光微板reader。
3.3 LOX表达与临床特征的关联分析
实验目的:比较LOX-high组与LOX-low组的临床特征差异,探讨LOX表达的影响因素。
方法细节:收集患者初诊时的临床特征(年龄、WBC、LDH、细胞遗传学风险、分子突变、AML亚型、FAB亚型、EM AML状态),采用Mann-Whitney-U检验(连续变量)和卡方检验(分类变量)比较组间差异。
结果:LOX-high组具有以下不良临床特征:①疾病来源:继发性AML(11% vs 4%)、治疗相关AML(7% vs 4%)比例更高(p=0.001);②细胞形态:FAB M5亚型(单核细胞白血病)比例更高(23% vs 14%,p<0.001);③细胞遗传学:不良风险核型(34% vs 16%)、复杂核型(≥3种异常,12% vs 5%)、del(5q)(5% vs 1%)、t(9;11)(6% vs 1%)及11q23异常(8% vs 2%)比例更高(p<0.001);④分子突变:FLT3-ITD(17% vs 30%)、NPM1突变(26% vs 38%)比例更低(p<0.001、p=0.002);⑤EM AML:LOX-high组EM AML比例更高(13% vs 8%,p=0.037)。
3.4 生存分析与多因素交互作用研究
实验目的:评估LOX表达对AML患者总生存(OS)和无事件生存(EFS)的影响,及LOX与EM AML的交互作用。
方法细节:OS定义为“入组至死亡/末次随访”,EFS定义为“入组至死亡/诱导失败/复发”;采用Kaplan-Meier法估计生存曲线,log-rank检验比较组间差异;多因素Cox回归分析纳入细胞遗传学风险、年龄、FLT3-ITD、NPM1、log10(WBC)、诱导后第15天骨髓原始细胞比例、EM AML状态及LOX表达,同时引入“LOX×EM AML”交互项。
结果:①单因素分析:LOX-high组3年OS(47% vs 53%,p=0.022)和3年EFS(27% vs 35%,p=0.005)显著低于LOX-low组(图1);②多因素分析:LOX表达本身无独立预后意义,但“LOX-high×EM AML”交互项对OS(HR=2.25,95% CI 1.11-4.56,p=0.025)和EFS(HR=2.48,95% CI 1.26-4.86,p=0.008)有独立影响,提示两者协同增加死亡或复发风险。
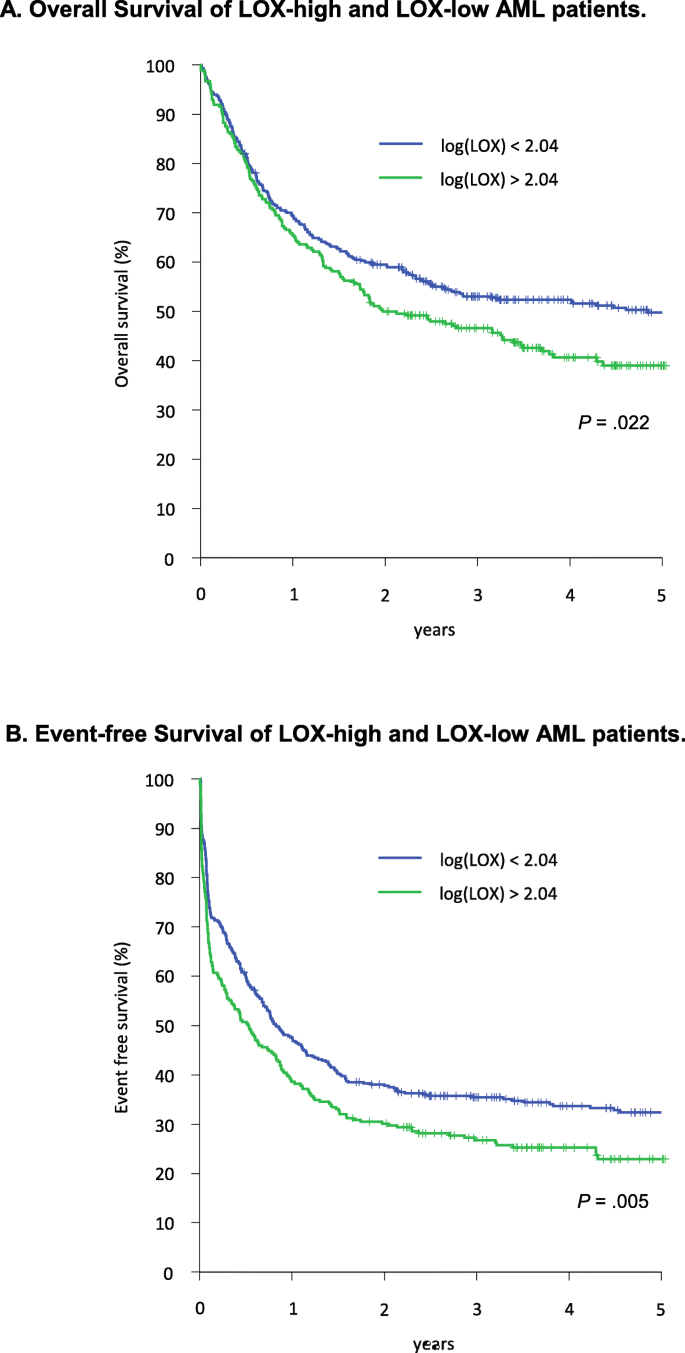
图1:LOX-high组与LOX-low组的OS(a)和EFS(b)曲线,LOX-high组生存显著更差。
3.5 EM AML亚组的LOX表达与预后分析
实验目的:验证LOX在EM AML患者中的预后价值。
方法细节:从总队列中筛选出59例经组织学证实的EM AML患者(10%),按LOX cutoff值分为LOX-high(n=31)和LOX-low(n=28)组,比较两组临床特征及生存差异。
结果:①临床特征:LOX-high组中,继发性/治疗相关AML(29% vs 11%)、FAB M5亚型(39% vs 14%)、不良核型(55% vs 18%)及11q23异常(29% vs 4%)比例更高(p<0.05);②生存分析:LOX-high组3年OS(13% vs 43%,p=0.002)和3年EFS(6% vs 36%,p=0.008)显著低于LOX-low组(图2),提示LOX可进一步分层EM AML患者的预后。
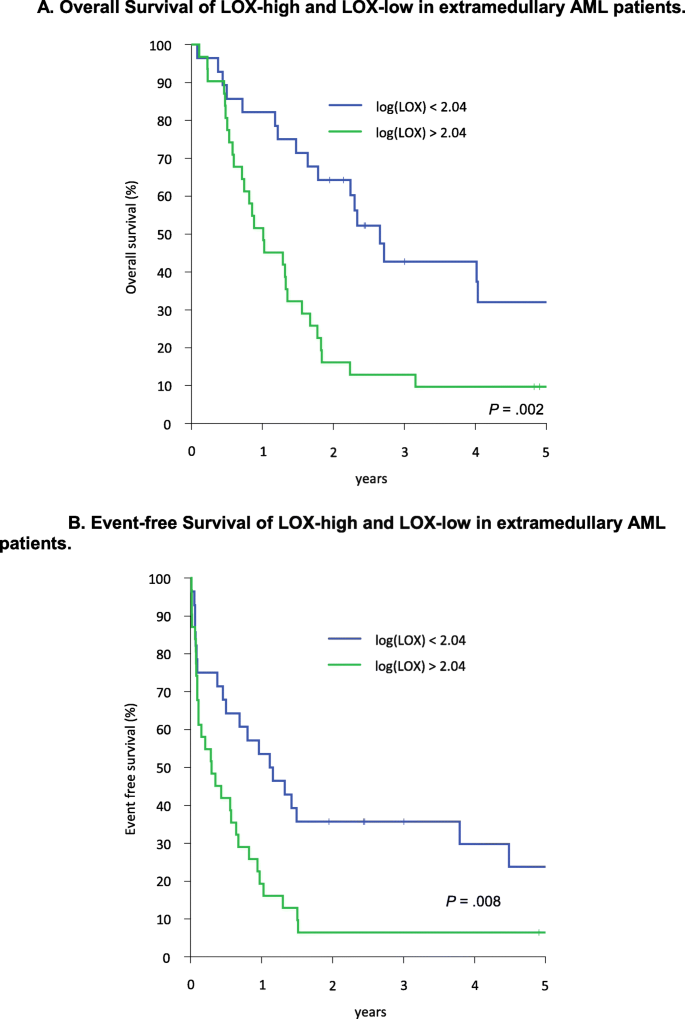
图2:EM AML患者中LOX-high组与LOX-low组的OS(a)和EFS(b)曲线,LOX高表达显著缩短生存。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为血浆赖氨酸氧化酶(LOX),属于蛋白类非侵入性生物标志物。其筛选逻辑基于“实体瘤LOX与转移的关联→AML EM病变的转移特征→LOX与AML的研究空白”;验证逻辑为“大样本队列检测→临床特征关联→生存分析→EM AML亚组验证→多因素交互作用分析”,形成完整的“检测-关联-验证”链条。
研究过程详述
- Biomarker来源:初诊AML患者的外周血锂肝素血浆(非侵入性样本,易于重复获取);
- 验证方法:使用荧光酶联免疫吸附试验(Amplite试剂盒)定量检测LOX浓度,通过最小p值法确定cutoff值(109 ng/mL);
- 特异性与敏感性:在总队列中,LOX-high组EM AML比例更高(13% vs 8%,p=0.037),提示LOX对EM AML有一定识别能力;在EM AML亚组中,LOX-high组的OS(13% vs 43%)和EFS(6% vs 36%)显著更差,显示其对EM AML患者的预后分层能力。
核心成果提炼
- LOX高表达与AML不良临床特征相关:包括继发性/治疗相关AML、FAB M5亚型、不良细胞遗传学异常(复杂核型、11q23异常)及EM AML;
- LOX高表达与AML不良预后相关:总队列中,LOX-high组3年OS(47% vs 53%,p=0.022)和EFS(27% vs 35%,p=0.005)显著更差;
- LOX与EM AML的交互作用对预后有独立影响:多因素分析显示,“LOX-high×EM AML”交互项的HR为2.25(OS,p=0.025)和2.48(EFS,p=0.008),提示两者协同增加死亡或复发风险;
- LOX可分层EM AML患者的预后:EM AML患者中,LOX-high组的3年OS(13%)和EFS(6%)显著低于LOX-low组(43%、36%),解决了EM AML预后异质性的问题。
创新性与意义
本研究的核心创新在于:首次发现LOX与EM AML的交互作用对AML预后的独立影响,为EM AML这一预后争议群体提供了客观的预后分层生物标志物。此外,LOX作为血浆标志物,具有非侵入性、易于检测的优势,有望应用于临床实践——通过检测初诊AML患者的LOX血浆水平,可早期识别高风险患者(尤其是EM AML患者),指导个体化治疗(如加强巩固治疗或造血干细胞移植)。
研究局限性:①EM AML的诊断依赖组织学证实,可能遗漏无临床症状的EM AML患者(需18FDG-PET/CT系统筛查);②未探讨LOX的调控机制(如HIF-1通路)及与白血病细胞浸润的功能关联(需体外实验验证);③未在独立队列中验证LOX的预后价值(需后续研究)。
