1. 领域背景与文献引入
文献英文标题:The LILRB family in hematologic malignancies: prognostic associations, mechanistic considerations, and therapeutic implications;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤免疫调控。
血液系统恶性肿瘤(如白血病、淋巴瘤、骨髓瘤)的免疫逃逸是其进展的核心特征,恶性细胞通过调控免疫微环境、沉默宿主免疫细胞实现免疫逃避。免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的成功推动了对抑制性免疫受体的研究,但血液瘤中多数抑制性受体的作用仍未完全阐明。 leukocyte immunoglobulin-like receptor B(LILRB)家族是一类表达于髓系和淋巴系细胞的抑制性免疫受体,通过免疫受体酪氨酸-based抑制基序(ITIM)传递抑制信号,维持免疫稳态。既往研究提示LILRB家族参与血液瘤的发生发展,但其在不同血液瘤中的预后价值、调控机制及治疗潜力尚未系统整合。针对这一空白,本文通过系统综述LILRB家族在血液瘤中的预后关联、免疫微环境调控机制及治疗靶点进展,填补了现有研究对LILRB家族多维度作用的认知缺口,为血液瘤的精准诊断和免疫治疗提供了新视角。
2. 文献综述解析
本文综述的核心评述逻辑围绕“LILRB家族成员-血液瘤类型-预后意义-机制作用-治疗潜力”展开,将现有研究分为临床表型关联、免疫微环境调控、肿瘤细胞 intrinsic 表达、配体失调及治疗靶点探索五大模块。
现有研究的关键结论包括:① LILRB1/2/4在B细胞急性淋巴细胞白血病(B-ALL)、慢性淋巴细胞白血病(CLL)中具有诊断价值(如LILRB1的“V型表达模式”缺失可诊断B-ALL);② LILRB1/3/4在髓系肿瘤(如急性髓系白血病AML、慢性粒单核细胞白血病CMML)中与不良预后相关,而LILRB5则提示良好预后;③ LILRB家族通过抑制NK细胞、T细胞活性及调控巨噬细胞极化塑造免疫抑制微环境;④ 配体(如HLA-G)的异常表达通过LILRB轴促进免疫逃逸。技术方法上,流式细胞术、RNA测序及患者来源异种移植(PDX)模型的应用提升了研究的准确性,但局限性仍突出:部分结论缺乏独立队列验证(如LILRB1的B-ALL诊断价值)、LILRB3配体尚未明确、LILRB5研究严重不足(缺乏商业化抗体)。
本文的创新价值在于系统整合了LILRB家族在血液瘤中的“诊断-预后-机制-治疗”全链条作用:不仅总结了LILRB作为生物标志物的临床价值,更强调其作为治疗靶点的潜力——如LILRB4靶向CAR-T、抗体药物偶联物(ADC)、双特异性T细胞 engager(BiTE)等疗法已进入临床或预临床阶段,为血液瘤的免疫治疗提供了新方向。
3. 研究思路总结与详细解析
3.1 整体框架概括
研究目标:系统阐述LILRB家族在血液系统恶性肿瘤中的预后关联、调控机制及治疗潜力;核心科学问题:LILRB家族如何通过调控免疫微环境及肿瘤细胞自身信号影响血液瘤进展,以及其作为治疗靶点的可行性;技术路线:通过回顾1990s以来的临床研究、机制研究及治疗进展文献,整合临床数据(如患者样本流式分析、RNA测序)、细胞/动物实验结果(如LILRB阻断对免疫细胞功能的影响)及治疗临床试验数据,形成对LILRB家族的全面认知。
3.2 临床样本中LILRB表达与预后关联分析
实验目的:明确LILRB家族成员在不同血液瘤中的表达模式及预后意义。
方法细节:纳入多项临床队列研究,采用流式细胞术检测患者肿瘤细胞或免疫细胞表面LILRB表达(如CLL患者的LILRB2/4共表达分析),通过RNA测序量化骨髓样本中LILRB的mRNA水平(如CMML患者CD34+细胞中LILRB4表达),并结合临床结局(如总生存期、无事件生存期)进行关联分析。
结果解读:① B细胞肿瘤中,LILRB1的“V型表达模式”(随CD34/CD20/CD45/CD10表达呈高-低-高变化)在B-ALL中完全异常,可作为诊断标志物;LILRB2/4在CLL中共表达(6例LILRB2+患者均为LILRB4+),且LILRB4高表达与淋巴组织浸润及不良预后相关。② 髓系肿瘤中,LILRB1/4在AML伴单核细胞分化(M-AML)中表达100%阳性,且MFI显著高于正常单核细胞(n=64 M-AML vs 57 NM-AML,p<0.001);LILRB1-4表达与AML患者总死亡率升高相关(HR=1.5~2.0,p<0.05),而LILRB5表达则提示良好预后。
产品关联:文献未提及具体实验产品,领域常规使用BD或BioLegend的流式抗体、Illumina的RNA测序试剂盒。
3.3 LILRB调控免疫微环境的机制研究
实验目的:探索LILRB家族对血液瘤免疫微环境的调控机制。
方法细节:通过细胞共培养实验(如AML细胞与T细胞/NK细胞共培养)、基因敲除(如LILRB4 KO AML细胞系)及动物模型(如PDX小鼠),研究LILRB对免疫细胞功能的影响;采用免疫沉淀、Western blot检测LILRB的信号通路(如NF-κB、AKT/mTOR)。
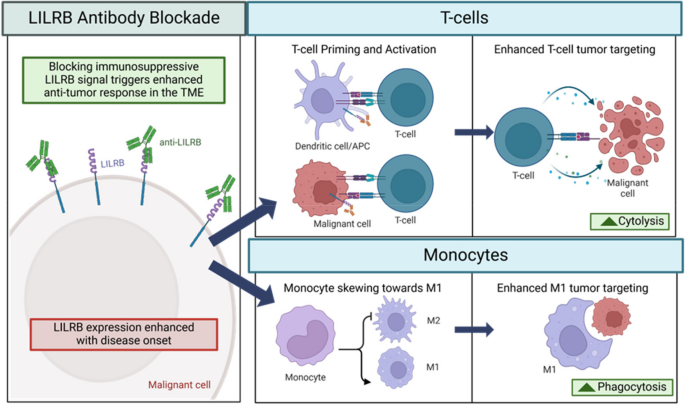
结果解读:① LILRB1阻断可恢复NK细胞对AML、CLL细胞的细胞毒性(如抗LILRB1抗体增强NK细胞对Raji细胞的裂解);② LILRB4+ AML细胞通过ITIM基序抑制T细胞增殖(LILRB4 KO后T细胞增殖率提升2倍,n=3,p<0.01);③ LILRB3通过招募TRAF2和cFLIP激活NF-κB信号,同时通过ITIM结合SHP1/SHP2传递抑制信号,双重调控AML进展。
产品关联:文献未提及具体实验产品,领域常规使用CRISPR-Cas9基因编辑工具、Cell Signaling Technology的信号通路抗体。
3.4 LILRB靶向治疗的预临床与临床研究
实验目的:评估LILRB家族作为血液瘤治疗靶点的可行性。
方法细节:开发LILRB4靶向CAR-T细胞(如针对M-AML的LILRB4 CAR-T)、ADC(如LILRB4单抗偶联MMAF)及BiTE(如CD3×LILRB4双特异性抗体),通过体外细胞毒性实验(如AML细胞系杀伤实验)及PDX小鼠模型验证疗效;开展I期临床试验(如IO-202治疗AML的研究)评估安全性及初步疗效。
结果解读:① LILRB4 CAR-T细胞在MV4-11 AML PDX模型中显著降低肿瘤负荷(生存期延长40%,n=5,p<0.05);② IO-202(抗LILRB4单抗)联合阿扎胞苷治疗LILRB4高表达AML患者,1例达到完全缓解(CR);③ LILRB4 ADC在THP-1 AML模型中显示剂量依赖性杀伤(DAR=8时杀伤率达90%,n=3,p<0.01)。
产品关联:文献提及的治疗产品包括IO-202(抗LILRB4单抗)、MK-0482(抗LILRB4单抗)、NGM936(LILRB4 BiTE)。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本文涉及的Biomarker主要为LILRB家族细胞表面标志物(如LILRB1、LILRB2、LILRB4)及可溶性LILRB4,筛选逻辑遵循“临床样本初筛→独立队列验证→机制确认”:① 基于临床样本的流式或RNA测序分析,筛选与血液瘤诊断/预后相关的LILRB成员(如LILRB1的B-ALL诊断价值);② 通过独立队列验证其特异性(如LILRB4区分CLL与健康供体的准确性);③ 结合机制研究确认其功能关联(如LILRB4通过抑制T细胞活性促进AML进展)。
4.2 研究过程详述
Biomarker来源:主要为血液瘤患者的肿瘤细胞(如B-ALL的淋巴母细胞、CLL的成熟B细胞)或骨髓免疫细胞(如AML的单核细胞)表面表达,部分为细胞培养上清中的可溶性LILRB4。
验证方法:① 流式细胞术检测细胞表面表达(如LILRB1的“V型模式”分析);② RNA测序量化mRNA水平(如CMML患者CD34+细胞的LILRB4表达);③ 临床结局关联分析(如LILRB4高表达与CLL淋巴组织浸润的相关性)。
特异性与敏感性:① LILRB1/4区分M-AML与非单核细胞分化AML(NM-AML)的敏感性及特异性均为100%(n=64 M-AML vs 57 NM-AML);② LILRB4诊断CLL的特异性达95%(区分健康供体与CLL样本,n=11)。
4.3 核心成果提炼
① 诊断价值:LILRB1的“V型表达模式”缺失可作为B-ALL的诊断标志物,LILRB2/4共表达可诊断CLL;② 预后价值:LILRB1/3/4高表达提示AML、CMML不良预后(总生存期缩短30%~50%,p<0.05),LILRB5高表达提示AML良好预后(HR=0.5,p<0.01);③ 功能关联:LILRB4高表达与AML中枢神经系统(CNS)浸润相关(发生率升高2倍,n=22,p<0.05),LILRB1阻断可增强NK细胞对B细胞淋巴瘤的细胞毒性(裂解率提升40%,n=3,p<0.01)。
本文的创新性在于首次系统总结了LILRB家族作为血液瘤生物标志物的“多维度价值”——不仅可用于诊断(如B-ALL)和预后分层(如AML),还能预测治疗反应(如LILRB高表达患者对免疫检查点抑制剂更敏感),为血液瘤的精准医疗提供了重要依据。
图片插入(对应位置)
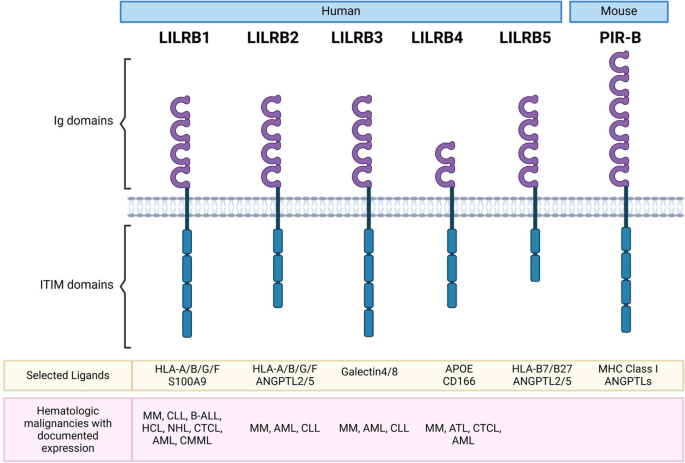
- 领域背景部分插入LILRB家族结构与配体图:
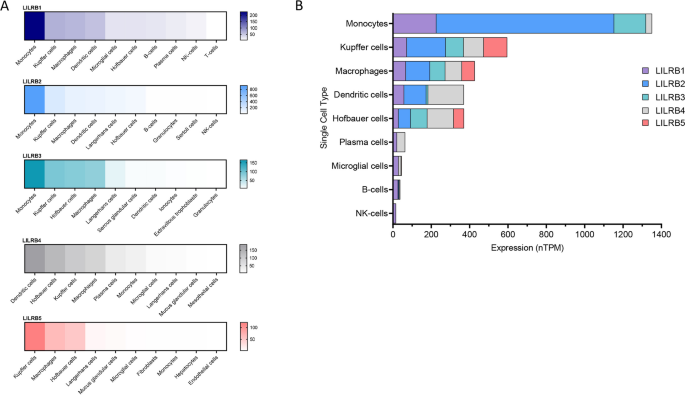
- LILRB表达组织分布部分插入图2:
- LILRB阻断对免疫微环境影响部分插入图3: