1. 领域背景与文献引入
文献英文标题:Elevated doublecortin-like kinase 1 serum levels revert to baseline after therapy in early stage esophageal adenocarcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:食管腺癌生物标志物。
胃食管反流病(gastroesophageal reflux disease, GERD)是影响约20%美国人的慢性疾病,长期胃内容物反流可导致食管鳞状上皮炎症,进而发展为巴雷特食管(Barrett’s esophagus, BE)——一种以食管上皮肠化生为特征的癌前病变。BE患者若进展至高度不典型增生(high grade dysplasia, HGD),后续罹患食管腺癌(esophageal adenocarcinoma, EAC)的风险显著升高。据统计,美国EAC发病率在过去30年间增长超过6倍,而患者5年生存率仅约15%,预后极差。目前,早期EAC的主要治疗手段包括内镜黏膜切除术(endoscopic mucosal resection, EMR)和射频消融术(radio-frequency ablation, RFA),但治疗后仍有17%的患者因肿瘤干细胞未完全清除而复发。然而,EAC治疗反应的生物标志物研究一直进展缓慢,至今缺乏可靠的非侵入性标志物用于评估治疗效果或监测复发。双皮质素样激酶1(doublecortin-like kinase 1, DCLK1)作为癌症干细胞标志物,此前研究发现其在BE伴HGD或EAC患者的组织及血清中高表达,提示其可能与疾病进展相关。基于此,本研究旨在探索血清DCLK1能否作为EAC治疗后疾病消退的非侵入性生物标志物,填补EAC疗效监测的生物标志物空白。
2. 文献综述解析
文献综述围绕EAC的疾病进展链、现有治疗局限性及生物标志物研究现状展开。作者首先梳理了“GERD→BE→EAC”的疾病进展逻辑,强调BE作为EAC癌前病变的关键地位,及EAC高发病率、低生存率的临床困境;接着指出当前EAC治疗(EMR联合RFA)虽能切除早期病变,但因无法彻底清除肿瘤干细胞,复发率较高(约17%);同时,现有生物标志物研究未能提供可靠的治疗反应评估工具,EAC治疗后的疗效监测仍依赖内镜等侵入性检查。此外,作者回顾了DCLK1的研究背景:DCLK1是胃肠道(gastrointestinal, GI) tract中感觉/分泌性tuft细胞的标志物,参与炎症反应和肿瘤发生,在结肠炎、胰腺炎等炎症相关疾病及结直肠癌、胰腺癌中,DCLK1+细胞被证实是肿瘤的细胞起源。此前研究已发现BE和EAC患者的组织及血清中DCLK1水平升高,但尚未探索其与EAC治疗反应的关系。基于现有研究的局限——缺乏DCLK1在EAC治疗后动态变化的数据,本研究的创新点在于首次聚焦EAC治疗前后血清DCLK1的变化,验证其作为治疗反应生物标志物的潜力,为EAC疗效监测提供新的非侵入性手段。
3. 研究思路总结与详细解析
本研究以“探索血清DCLK1作为EAC治疗后疾病消退生物标志物”为核心目标,围绕“EAC治疗是否降低血清DCLK1水平”这一科学问题,采用“患者入组→样本采集→指标检测→统计分析”的闭环技术路线。
3.1 研究对象入组与样本采集
实验目的是获取不同疾病阶段的血清样本,为后续DCLK1水平分析提供基础。方法细节为入组5名正常对照(上消化道内镜检查正常)、9名BE患者(含3名低度不典型增生、6名高度不典型增生)、14名早期EAC患者(I/II期,治疗前)及6名EAC治疗后患者(治疗结束时),于入组时及治疗结束时采集血清样本,共获取34份血清样本。结果显示,各组患者基线信息明确,除正常对照年龄显著低于其他组(中位数49岁)外,性别等因素无显著差异(文献未明确提供性别分布的具体数据)。
3.2 血清DCLK1水平的ELISA检测
实验目的是定量检测不同分组的血清DCLK1水平。方法细节为使用Cloud Clone Corporation的DCLK1免疫酶联吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒,按照说明书操作:将包被DCLK1单克隆抗体的96孔板预封闭,用0-10ng/mL的纯化DCLK1蛋白建立标准曲线,血清样本以磷酸盐缓冲液(PBS)稀释1:4或1:10后加入板中,室温孵育2小时;随后加入生物素化DCLK1多克隆抗体孵育1小时,洗涤后加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的链霉亲和素孵育30分钟;最后加入HRP底物显色20分钟,终止反应后检测450nm处吸光度(OD450),通过标准曲线计算血清DCLK1浓度。结果显示,标准曲线拟合良好,成功定量各样本的DCLK1水平(文献未明确标准曲线的R²值,但提及基于标准曲线计算浓度)。实验所用关键产品:Cloud Clone Corporation的DCLK1 ELISA试剂盒(未提及货号)。
3.3 统计分析与结果验证
实验目的是分析血清DCLK1水平的组间差异及与临床因素的相关性。方法细节为采用Kruskal-Wallis检验比较多组间DCLK1水平差异,Mann Whitney U检验比较两组间差异,受试者工作特征曲线(receiver operating characteristic, ROC)分析评估DCLK1对疾病状态的区分能力,Pearson相关分析评估DCLK1与年龄的相关性。结果显示:BE患者(n=9)和EAC治疗前患者(n=14)的血清DCLK1水平较正常对照(n=5)升高超过50%,差异具有统计学意义(p=0.0007);EAC治疗后患者(n=6)的血清DCLK1水平较治疗前降低超过50%,差异显著(p=0.033)。ROC分析显示,DCLK1区分EAC与正常对照的曲线下面积(area under the curve, AUC)为0.971(p=0.0016),区分BE与正常对照的AUC为0.911(p=0.0136),区分EAC治疗后与治疗前的AUC为0.833(p=0.0209)。此外,血清DCLK1水平与患者年龄无显著相关性(Pearson r=0.08,p=0.66),性别对DCLK1水平也无显著影响(文献未提供具体数据)。
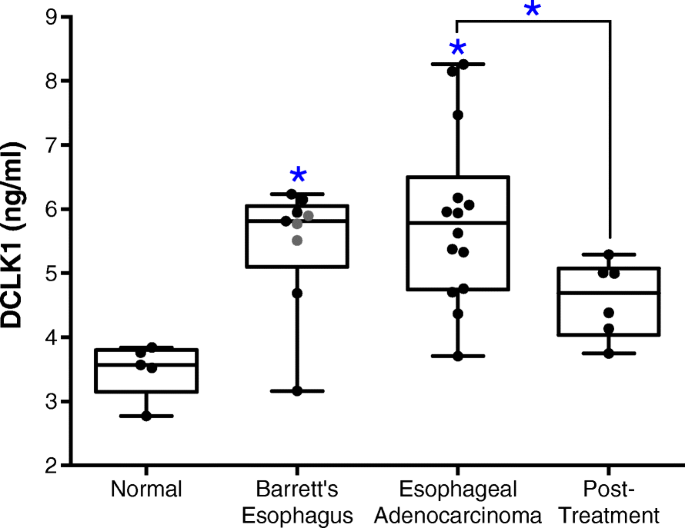
(图1:正常对照、BE、EAC治疗前及治疗后血清DCLK1水平比较,p=0.0029)
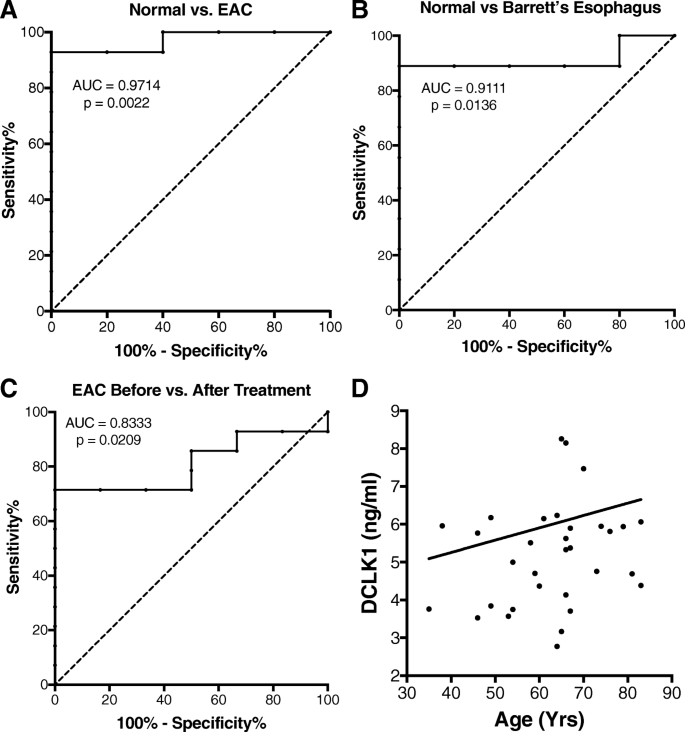
(图2:DCLK1区分不同疾病状态的ROC曲线及与年龄的相关性分析)
4. Biomarker研究及发现成果解析
Biomarker定位:本研究关注的生物标志物为血清DCLK1,属于循环蛋白类生物标志物。其筛选逻辑基于此前研究发现DCLK1在BE伴HGD或EAC中高表达,且为癌症干细胞标志物;验证逻辑为通过“正常对照→BE→EAC治疗前→EAC治疗后”的梯度分组,结合ELISA定量检测与统计分析,验证DCLK1与疾病状态及治疗反应的关联。
研究过程详述
血清DCLK1的来源为不同疾病阶段患者的外周血血清——正常对照来自上消化道内镜正常者,BE患者来自伴低/高度不典型增生的巴雷特食管患者,EAC治疗前患者来自I/II期食管腺癌患者,EAC治疗后患者来自上述EAC患者治疗结束时的血清。验证方法为ELISA定量检测,通过标准曲线准确计算血清DCLK1浓度。特异性与敏感性数据方面,DCLK1区分EAC与正常对照的AUC为0.971(提示高敏感性和特异性),区分BE与正常对照的AUC为0.911,区分EAC治疗后与治疗前的AUC为0.833。
核心成果提炼
血清DCLK1水平与EAC疾病状态显著相关——EAC治疗前水平显著升高(较正常对照高50%以上,p=0.0007,n=14 vs 5),治疗后回落至接近正常水平(较治疗前低50%以上,p=0.033,n=6 vs 14),提示其可作为EAC治疗后疾病消退的非侵入性生物标志物;其创新性在于首次报道EAC治疗后血清DCLK1的动态变化,填补了EAC治疗反应生物标志物的研究空白。此外,血清DCLK1水平与患者年龄无显著相关性(p=0.66),排除了年龄对结果的干扰。
本研究为EAC患者的治疗效果监测提供了新的非侵入性工具,未来若能扩大样本量验证其长期稳定性及与复发的关联,有望进一步提升EAC患者的预后管理水平。
