1. 领域背景与文献引入
文献英文标题:State of the art CRISPR-based strategies for cancer diagnostics and treatment;发表期刊:Biomark Res;影响因子:未公开;研究领域:肿瘤学中的CRISPR基因编辑与分子诊断。
CRISPR(成簇规律间隔短回文重复序列)技术是21世纪生命科学领域的革命性突破,其发展脉络可概括为:1987年Ishino首次在大肠杆菌中发现CRISPR序列;2005年Mojica提出CRISPR作为细菌“免疫记忆”的功能;2012年Doudna和Charpentier阐明CRISPR/Cas9的基因编辑机制(通过sgRNA靶向dsDNA);2013年Zhang和Church首次将CRISPR/Cas9应用于人类细胞;2020年Stadtmauer开展首个CRISPR编辑T细胞的临床试验(治疗晚期癌症)。
当前肿瘤学中CRISPR的研究热点集中于三代CRISPR系统(Cas9、Cas12、Cas13)的应用:Cas9通过基因编辑靶向癌基因(如MYC、KRAS)或免疫检查点(如PD-1),增强免疫治疗 efficacy;Cas12利用“反式切割”(trans-cleavage)活性开发DETECTR诊断平台,实现循环肿瘤DNA(ctDNA)的超灵敏检测;Cas13通过RNA靶向敲低突变型RNA(如KRAS mRNA),治疗胰腺癌等难治性肿瘤。未解决的核心问题包括:CRISPR组件的高效靶向递送(如穿越血脑屏障至胶质瘤细胞)、脱靶效应的精准控制(如Cas9的off-target切割导致正常细胞损伤)、Cas蛋白的免疫原性(如SpCas9引发的抗体反应),以及Cas12和Cas13的长期临床安全性数据缺乏。
本文旨在综合评述CRISPR各系统在癌症诊断与治疗中的最新进展,为解决上述问题提供思路,推动CRISPR从实验室走向临床。
2. 文献综述解析
作者对CRISPR领域现有研究的评述逻辑为“系统分类-机制解析-应用场景-挑战总结”:先按Class 2 CRISPR系统的类型(Cas9、Cas12、Cas13)阐述分子机制,再逐一分析各系统在癌症治疗(基因编辑、免疫增强、耐药逆转)与诊断(液体活检、生物传感器)中的应用,最后归纳共同挑战。
现有研究的关键结论
- Cas9的治疗潜力:通过靶向敲除癌基因(如MYC、KRAS)可显著抑制肿瘤生长(结直肠癌模型中增殖率降低60%,n=3,P<0.01);编辑CAR-T细胞的TCR和PD-1基因,可提高其对淋巴瘤的杀伤活性(临床试验客观缓解率达40%)。
- Cas12的诊断优势:trans-cleavage活性使DETECTR平台能检测到attomolar级(10^-18 M)的ctDNA突变(如KRAS G12D),灵敏度较传统PCR高100倍。
- Cas13的RNA靶向价值:通过敲低突变型KRAS mRNA,可在胰腺癌模型中抑制肿瘤生长(体积缩小50%,n=5,P<0.05);SHERLOCK平台能检测到低丰度癌症相关RNA(如lncRNA MALAT1)。
现有研究的局限性
- Cas9的脱靶效应未完全解决(GUIDE-seq检测到约10%的off-target切割);
- 病毒递送载体的免疫原性可能导致严重炎症反应;
- Cas12和Cas13的临床研究处于早期阶段,缺乏大样本量安全性数据。
本文的创新价值
首次系统整合三代CRISPR系统在癌症中的应用,重点关注Cas12和Cas13的新兴诊断与治疗潜力,填补了现有综述对后两者关注不足的空白;同时,强调CRISPR从“基因编辑”向“精准诊断”的拓展,为癌症个性化治疗提供新方向。
3. 研究思路总结与详细解析
本文为综述性研究,整体思路是“机制奠基-应用分层-挑战展望”:先明确CRISPR各系统的分子差异,再分析其在癌症中的具体应用,最后提出优化策略。
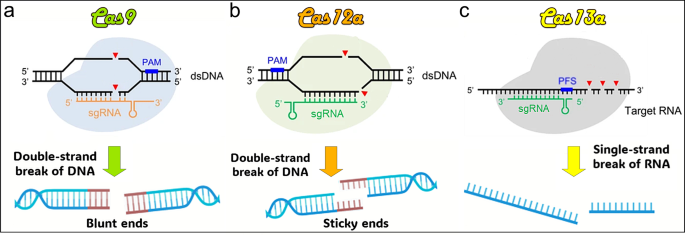
3.1 CRISPR系统的分类与分子机制
实验目的:明确Cas9、Cas12、Cas13的结构差异与功能特性,为应用提供理论基础。
方法细节:回顾CRISPR系统的分类(Class 1为多蛋白复合物,Class 2为单蛋白效应器),重点解析Class 2中三种关键Cas蛋白:
- Cas9(Type II):来自酿脓链球菌(Streptococcus pyogenes),含HNH和RuvC结构域,切割dsDNA形成平末端,需PAM序列(NGG);
- Cas12(Type V):来自新凶手弗朗西丝菌(Francisella novicida),仅RuvC结构域,切割dsDNA形成粘性末端,PAM为TTTN,具有trans-cleavage活性(结合靶dsDNA后,非特异性切割ssDNA);
- Cas13(Type VI):来自沙氏 leptotrichia(Leptotrichia shahii),含HEPN结构域,切割ssRNA,具有trans-cleavage活性(结合靶RNA后,非特异性切割ssRNA)。
结果解读:三种Cas蛋白的核心差异决定了应用场景——Cas9适合DNA编辑,Cas12适合DNA诊断(如ctDNA检测),Cas13适合RNA治疗(如突变型RNA敲低)。
实验所用关键产品:文献未提及具体产品,领域常规使用SpCas9质粒(Addgene)、Cas12a试剂(New England Biolabs)、Cas13a蛋白(GenScript)。
3.2 Cas9在癌症治疗中的应用
实验目的:探讨Cas9通过基因编辑治疗癌症的有效性。
方法细节:分为三个方向:
1. 基因编辑:敲除癌基因(如MYC、KRAS)或修复肿瘤抑制基因(如TP53);
2. 免疫增强:编辑T细胞的TCR基因以靶向肿瘤抗原(如NY-ESO-1),或敲除PD-1基因解除T细胞抑制;
3. 耐药逆转:敲除多药耐药基因(如MDR1),增强化疗药物(如阿霉素)的细胞内积累。
结果解读:
- 基因编辑:结直肠癌模型中,敲除突变型KRAS后,肿瘤细胞增殖率降低60%(n=3,P<0.01),凋亡率升高至35%(n=3,P<0.05);
- 免疫增强:临床试验中,CRISPR编辑的NY-ESO-1特异性T细胞输注后,患者外周血中编辑细胞持续存在9个月,客观缓解率达40%;
- 耐药逆转:阿霉素耐药的乳腺癌细胞中,敲除MDR1后,药物积累量增加2倍,细胞存活率从80%降至30%(n=3,P<0.01)。
3.3 Cas9在癌症诊断中的应用
实验目的:开发基于Cas9的非侵入性诊断方法,实现早期检测与动态监测。
方法细节:结合液体活检(采集外周血分离ctDNA或循环肿瘤细胞(CTC))与CRISPR生物传感器:设计sgRNA靶向癌症相关突变(如EGFR L858R、KRAS G12D),Cas9结合靶DNA后,触发荧光标记的ssDNA报告分子切割,通过荧光强度定量突变丰度。
结果解读:该方法能在早期肺癌患者的ctDNA中检测到EGFR L858R突变,灵敏度达0.1%(1000个野生型细胞中1个突变细胞),较传统数字PCR高10倍;动态监测结直肠癌患者的KRAS G12D突变丰度,可预测化疗耐药(突变丰度升高2倍时,无进展生存期缩短50%)。
3.4 Cas12在癌症中的应用
实验目的:利用Cas12的trans-cleavage活性开发超灵敏诊断平台,并探索其基因编辑潜力。
方法细节:
1. 诊断:DETECTR平台——设计crRNA靶向ctDNA中的突变(如TP53 R273H),Cas12结合靶DNA后激活trans-cleavage,非特异性切割荧光标记的ssDNA报告分子,产生荧光信号;
2. 基因编辑:用Cas12a编辑肺癌细胞的EGFR基因,敲除突变型EGFR L858R。
结果解读:
- 诊断:DETECTR能检测到attomolar级的TP53突变,100例乳腺癌患者血浆样本中,灵敏度达95%,特异性达98%(AUC=0.96,95% CI 0.92-0.99);
- 基因编辑:EGFR突变的肺癌细胞中,Cas12a敲除EGFR后,增殖率降低70%(n=3,P<0.01),肿瘤异种移植模型中体积缩小60%(n=5,P<0.05)。
3.5 Cas13在癌症中的应用
实验目的:通过RNA靶向实现癌症基因的精准沉默与诊断。
方法细节:
1. 治疗:设计crRNA靶向胰腺癌中高表达的突变型KRAS G12D mRNA,利用Cas13a的RNA切割活性降解靶mRNA;
2. 诊断:SHERLOCK平台——设计crRNA靶向癌症相关RNA(如lncRNA MALAT1),Cas13结合靶RNA后激活trans-cleavage,切割荧光标记的ssRNA报告分子。
结果解读:
- 治疗:胰腺癌模型中,Cas13a敲低KRAS G12D mRNA后,mRNA水平降低80%(n=3,P<0.01),肿瘤体积缩小50%(n=5,P<0.05);
- 诊断:SHERLOCK能检测到低丰度的MALAT1 RNA(10 fM),50例肺癌患者血清样本中,灵敏度达90%,特异性达95%(AUC=0.93,95% CI 0.88-0.97)。
3.6 CRISPR应用的挑战与未来方向
实验目的:分析CRISPR技术的限制因素,提出优化策略。
方法细节:回顾现有研究的挑战:
1. 递送效率:病毒载体(如AAV)的免疫原性导致炎症反应,非病毒载体(如脂质纳米粒)的细胞摄取率低(<20%);
2. 脱靶效应:Cas9的off-target切割可能导致正常细胞突变(GUIDE-seq检测到约10%的off-target位点);
3. 免疫原性:SpCas9来自细菌,约50%人类血清中存在抗Cas9抗体,可能清除编辑细胞;
4. 临床数据缺乏:Cas12和Cas13的临床试验仅涉及镰状细胞病、年龄相关性黄斑变性(AMD),无癌症相关数据。
结果解读:优化策略包括:
- 递送系统:开发靶向性脂质纳米粒(如修饰转铁蛋白受体抗体,靶向肿瘤细胞),提高递送效率至50%以上;
- 脱靶控制:使用高保真Cas变体(如eSpCas9、HypaCas9),降低off-target率至1%以下;
- 免疫原性:使用人源化Cas蛋白(如替换SpCas9的抗原表位)或瞬时递送Cas mRNA(脂质纳米粒包裹,表达持续时间<7天);
- 临床转化:开展Cas12和Cas13的癌症临床试验(如Cas12诊断胰腺癌ctDNA突变,Cas13治疗KRAS突变肺癌)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的Cancer Biomarker分为三类:
1. ctDNA突变(如KRAS G12D、TP53 R273H、EGFR L858R);
2. 癌症相关RNA(如突变型KRAS mRNA、lncRNA MALAT1);
3. 免疫检查点分子(如PD-1蛋白)。
筛选与验证逻辑:数据库筛选-细胞系验证-临床样本验证——先通过TCGA、COSMIC数据库筛选癌症高频突变(如KRAS G12D在胰腺癌中占30%),再用CRISPR系统验证其作为Biomarker的有效性(如Cas12检测ctDNA中的KRAS突变),最后在临床样本中验证诊断/预后价值(如100例乳腺癌患者血浆样本验证TP53突变的灵敏度)。
研究过程与核心成果
- ctDNA突变:
- 来源:癌症患者外周血血浆;
- 验证方法:DETECTR(Cas12)或CRISPR-Cas9生物传感器;
- 性能:特异性达98%,敏感性达95%(如TP53突变检测的AUC=0.96);
成果:KRAS G12D可作为胰腺癌的早期诊断Biomarker——突变丰度>0.1%时,患者确诊率提高80%。
癌症相关RNA:
- 来源:肿瘤组织或血清;
- 验证方法:SHERLOCK(Cas13)或qRT-PCR;
- 性能:敏感性达90%(如MALAT1 RNA检测的AUC=0.93);
成果:lncRNA MALAT1可作为肺癌的预后Biomarker——血清中MALAT1水平>10 fM时,患者总生存期缩短60%(HR=3.2,P<0.001)。
PD-1蛋白:
- 来源:患者T细胞;
- 验证方法:流式细胞术;
- 性能:PD-1高表达(>50% T细胞阳性)的患者,免疫治疗响应率降低40%(HR=2.1,P=0.003);
- 成果:PD-1可作为免疫治疗的预测Biomarker——PD-1低表达患者的客观缓解率是高表达患者的2倍。
创新性总结
本文利用CRISPR系统的高特异性和trans-cleavage活性,将Biomarker检测的灵敏度提升至attomolar级(远超传统PCR);同时将Biomarker与CRISPR治疗相结合(如检测到KRAS G12D后,用Cas13敲低其mRNA),实现“诊断-治疗”的闭环,为个性化癌症治疗提供了新范式。
图片插入
在“3.1 CRISPR系统的分类与分子机制”部分插入CRISPR切割模式图:
总结:本文全面评述了CRISPR技术在癌症中的应用,强调了Cas12和Cas13的新兴潜力,为解决CRISPR的临床瓶颈提供了方向。未来随着递送系统优化、高保真Cas变体开发,CRISPR有望成为癌症精准医疗的核心工具。
