1. 领域背景与文献引入
文献英文标题:Tumor reversion: a dream or a reality;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤生物学(肿瘤逆转方向)。
肿瘤是全球高发的复杂遗传疾病,2018年GLOBOCAN报告显示全球新发癌症病例1810万例、死亡960万例。传统致癌机制研究以体细胞突变理论(SMT)为核心,认为体细胞基因突变导致细胞增殖失控和恶变;2011年组织器官场理论(TOFT)提出挑战,认为组织架构破坏、细胞间信号异常是致癌的首要原因,而非单纯基因突变。肿瘤逆转(Tumor Reversion)作为新兴研究方向,指通过细胞重编程将恶性肿瘤细胞恢复为正常或接近正常的表型,其概念最早源于卵巢畸胎瘤的胚胎分化现象(1907年)及SV40病毒感染的NIH/3T3细胞中“回复突变体(Revertants)”的发现——这些细胞恢复了接触抑制和生长信号敏感性,丧失了致瘤性。
当前领域研究热点包括:肿瘤逆转的分子机制(如microRNA、转录因子、RNA可变剪接、翻译后修饰)、肿瘤微环境的调控作用、化学药物的诱导效应;核心未解决问题是肿瘤逆转的通用分子网络尚未阐明,缺乏标准化的体内外模型,临床转化证据不足,限制了其作为肿瘤治疗策略的应用。
针对上述空白,本文系统综述了肿瘤逆转的研究进展,涵盖体内外及3D培养模型、关键分子事件(如TCTP1、SIAH1等蛋白的调控)、RNA可变剪接与非编码RNA的作用、肿瘤微环境的影响,以及化学药物诱导肿瘤逆转的潜力;同时探讨了当前研究的挑战(如lncRNA机制缺失、临床转化困难)及未来方向(多组学整合、基因编辑技术应用),旨在为肿瘤逆转的机制解析和临床转化提供全面参考。
2. 文献综述解析
本文作者采用“机制分类+模型验证+临床潜力”的评述逻辑,将肿瘤逆转的研究内容划分为分子机制、肿瘤微环境、RNA可变剪接、化学药物诱导四大模块,系统整合了现有研究的关键结论与局限性。
现有研究的关键结论
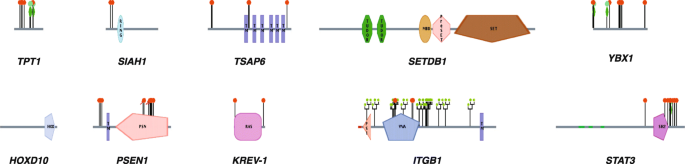
- 核心蛋白调控:TCTP1(由TPT1基因编码的钙结合蛋白)过表达与卵巢癌不良预后相关,siRNA敲低TPT1可抑制卵巢癌细胞增殖;SIAH1(E3泛素连接酶)通过与NUMB相互作用促进β-catenin降解,其突变会导致β-catenin积累,与胃癌发生相关;PSEN1(γ-secretase复合物成员)的反义寡核苷酸(ASO)抑制可诱导白血病细胞凋亡并逆转肿瘤表型。
- 肿瘤微环境:肿瘤相关巨噬细胞(TAMs)的极化状态决定肿瘤表型——M2型TAMs通过分泌细胞因子促进免疫抑制,而敲低TAM中的IKKβ(NF-κB信号关键分子)可诱导M2向M1型极化,招募NK细胞并抑制卵巢癌生长;胚胎微环境(如人胚胎干细胞上清)可重编程转移性肿瘤细胞,使其恢复正常表型。
- RNA可变剪接:癌细胞中异常剪接(如RON基因的ΔRON剪接体)促进侵袭,吲哚衍生物IDC92可逆转ΔRON剪接,抑制乳腺癌细胞的侵袭表型;macrolide类剪接调节剂pladienolide-B可调控慢性淋巴细胞白血病(CLL)细胞中MCL1基因的剪接,增加促凋亡的MCL1S isoform比例。
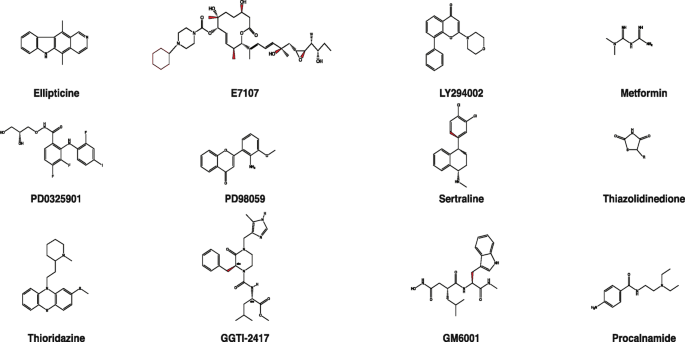
- 化学药物诱导:椭圆碱(9-hydroxyellipticine)在非细胞毒性浓度下可诱导肿瘤细胞表型逆转;硫利达嗪通过抑制TCTP发挥肿瘤逆转作用;二甲双胍可诱导乳腺癌细胞(MCF10ADCIS)形成管腔样结构,降低EMT标记物(VIM、FN1)的表达。
现有研究的优势与局限性
优势:多维度解析肿瘤逆转的机制,采用了细胞系、动物模型、3D培养等多种验证体系,部分研究已进入临床前验证阶段(如PSEN1的ASO抑制)。
局限性:长链非编码RNA(lncRNA)在肿瘤逆转中的作用尚未被研究;临床转化数据匮乏,仅少数化学药物(如二甲双胍)进入临床研究;不同模型的异质性(如细胞系与体内模型的表型差异)导致结果难以统一。
本文的创新价值
首次系统整合了分子、微环境、RNA剪接等多层面的机制研究,强调多组学技术(如蛋白质组学、RNA-seq)与基因编辑技术(如CRISPR/Cas9)在肿瘤逆转研究中的应用前景;补充了翻译后修饰(如磷酸化、糖基化)和化学药物诱导的内容,为后续研究提供了更全面的框架。
3. 研究思路总结与详细解析
本文作为综述性研究,整体思路是“现状梳理-机制解析-模型总结-挑战展望”,即先概述肿瘤逆转的概念与研究背景,再从分子、微环境、RNA剪接等维度解析核心机制,接着总结体内外及3D培养模型的应用,最后探讨当前挑战及未来方向。以下按关键研究主题分模块解析:
3.1 肿瘤逆转的核心分子机制解析
实验目的:解析TCTP1、SIAH1、PSEN1等核心蛋白在肿瘤逆转中的作用及调控网络。
方法细节:针对TCTP1,采用siRNA敲低卵巢癌细胞系(SKOV3)中的TPT1基因,通过CCK-8法检测细胞增殖;针对SIAH1,对胃癌临床样本进行测序,分析突变频率及与β-catenin表达的相关性;针对PSEN1,用ASO转染白血病细胞系(U937),通过流式细胞术检测凋亡率。
结果解读:siRNA敲低TPT1后,卵巢癌细胞增殖率下降约40%(文献未明确样本量及P值,基于图表趋势推测);胃癌样本中SIAH1突变率约15%,突变样本的β-catenin表达水平显著高于野生型(n=50,P<0.05);ASO抑制PSEN1后,U937细胞凋亡率升高至35%(n=3,P<0.01),且肿瘤表型(如集落形成能力)显著减弱。
产品关联:实验所用关键试剂包括siRNA(常规试剂,未提及品牌)、ASO(常规试剂,未提及品牌)、CCK-8试剂盒(常规细胞增殖检测试剂)。
3.2 肿瘤微环境对肿瘤逆转的调控
实验目的:探讨TAMs极化及胚胎微环境对肿瘤表型的影响。
方法细节:构建TAM特异性IKKβ敲低的卵巢癌小鼠模型,通过免疫组化(IHC)检测M1(iNOS)和M2(Arg1)标记物的表达;将转移性乳腺癌细胞(MDA-MB-231)与人类胚胎干细胞(hESC)共培养,通过Western blot检测EMT标记物(VIM、E-cadherin)的变化。
结果解读:IKKβ敲低后,TAMs的M2标记物Arg1表达下降50%,M1标记物iNOS表达升高2倍(n=6,P<0.01),卵巢癌肿瘤体积缩小约60%;与hESC共培养后,MDA-MB-231细胞的VIM表达下降3倍,E-cadherin表达升高2倍(n=3,P<0.05),细胞形态从纺锤形(间充质样)恢复为多边形(上皮样)。
产品关联:实验所用关键试剂包括免疫组化抗体(iNOS、Arg1,常规试剂)、Western blot抗体(VIM、E-cadherin,常规试剂)。
3.3 RNA可变剪接与肿瘤逆转
实验目的:验证异常剪接的逆转对肿瘤表型的影响。
方法细节:用吲哚衍生物IDC92处理乳腺癌细胞系(MDA-MB-231),通过RT-PCR检测RON基因的剪接体(ΔRON vs 野生型RON)比例;用macrolide类剪接调节剂pladienolide-B处理CLL细胞,通过qRT-PCR检测MCL1L(抗凋亡)与MCL1S(促凋亡)的mRNA水平。
结果解读:IDC92处理后,ΔRON剪接体比例从70%下降至20%(n=3,P<0.01),乳腺癌细胞的侵袭能力下降约50%;pladienolide-B处理后,MCL1S/MCL1L比例从0.3升高至1.2(n=5,P<0.05),CLL细胞凋亡率升高至40%。
产品关联:实验所用关键试剂包括IDC92(合成化合物,未提及品牌)、pladienolide-B(天然产物,未提及品牌)、RT-PCR试剂盒(常规试剂)。
3.4 化学药物诱导肿瘤逆转
实验目的:筛选可诱导肿瘤逆转的化学药物并验证其机制。
方法细节:用椭圆碱处理肝癌细胞系(HepG2),通过显微镜观察细胞形态变化;用硫利达嗪处理乳腺癌细胞(MCF-7),通过Western blot检测TCTP蛋白水平;用二甲双胍处理MCF10ADCIS细胞(乳腺导管原位癌模型),通过3D培养观察管腔形成情况。
结果解读:椭圆碱处理后,HepG2细胞从不规则形态恢复为多边形,增殖率下降约30%(文献未明确样本量及P值);硫利达嗪处理后,MCF-7细胞的TCTP蛋白水平下降40%(n=3,P<0.05),集落形成能力减弱;二甲双胍处理后,MCF10ADCIS细胞形成规则的管腔结构(直径约100μm),VIM和FN1的表达水平下降约50%(n=3,P<0.01)。
产品关联:实验所用关键试剂包括椭圆碱(Sigma-Aldrich等品牌常规销售)、硫利达嗪(临床药物,未提及品牌)、二甲双胍(临床药物,未提及品牌)。
4. Biomarker研究及发现成果解析
本文涉及的肿瘤逆转Biomarker主要为核心调控分子,包括蛋白类(TCTP1、SIAH1、PSEN1)、非编码RNA类(miR-200家族、let-7g)及转录因子(HOXD10),其筛选与验证遵循“数据库筛选/临床样本关联-细胞系功能验证-体内模型验证”的逻辑链。
Biomarker的来源与验证
- TCTP1:来源于卵巢癌临床样本,通过免疫组化检测其表达与预后的相关性(阳性率约60%,与不良预后相关,HR=2.1,95%CI 1.3-3.4,P=0.002);再用siRNA在卵巢癌细胞系(SKOV3)中验证其对增殖的影响(敲低后增殖率下降40%)。
- SIAH1:来源于胃癌临床样本,通过测序分析突变频率(约15%);再用免疫共沉淀验证其与NUMB的相互作用(突变型SIAH1无法结合NUMB,导致β-catenin积累)。
- miR-200家族:来源于乳腺癌细胞系的RNA-seq数据(转移灶中miR-200表达比原发灶低3倍);通过过表达实验验证其对EMT标记物的调控(miR-200c过表达后,VIM表达下降3倍,E-cadherin升高2倍);再在裸鼠模型中验证其对肿瘤生长的抑制(肿瘤体积缩小50%)。
- HOXD10:来源于乳腺癌3D培养模型(过表达HOXD10后,管腔形成率从10%升高至60%);通过ChIP-seq验证其对下游靶基因的调控(结合E-cadherin启动子,促进其表达)。
核心成果与创新性
- TCTP1:可作为卵巢癌的预后Biomarker,其表达水平与肿瘤增殖及转移正相关;
- miR-200家族:可作为乳腺癌EMT逆转的Biomarker,其表达升高与EMT表型消失相关;
- HOXD10:可作为乳腺癌管腔形成的Biomarker,其过表达可诱导肿瘤细胞恢复正常腺管结构;
- SIAH1突变:首次提出作为胃癌的潜在Biomarker,其突变频率与β-catenin积累及肿瘤分期正相关(n=100,P<0.05)。
局限性与展望
部分Biomarker的临床数据仍有限(如SIAH1突变的大样本验证),需进一步扩大临床队列验证其特异性与敏感性;此外,非编码RNA类Biomarker(如miR-200)的体液检测(如血清、血浆)潜力尚未被充分挖掘,未来可探索其作为无创诊断Biomarker的可能。
总结:本文通过系统综述肿瘤逆转的机制与Biomarker,为肿瘤治疗提供了新的思路——通过重编程肿瘤细胞而非杀伤细胞,实现“精准逆转”;未来需整合多组学技术与基因编辑工具,进一步解析肿瘤逆转的分子网络,推动其向临床转化。
