1. 领域背景与文献引入
文献英文标题:Current advances and future perspectives on the functional roles and clinical implications of circular RNAs in esophageal squamous cell carcinoma: more influential than expected;发表期刊:Biomarker Research;影响因子:未公开;研究领域:食管鳞状细胞癌(ESCC)中的环状RNA(circRNA)研究。
食管鳞状细胞癌(ESCC)是全球发病率第七、死亡率第六的胃肠道恶性肿瘤,2020年全球新增60.4万例、死亡54.4万例。其预后差的核心原因是早期无特异性症状,约70%患者确诊时已达晚期或出现远处转移,且放化疗耐药率高,5年生存率不足20%。因此,探索ESCC的分子机制、寻找敏感特异的生物标志物及治疗靶点是领域亟待解决的问题。
环状RNA(circRNA)是一类具有共价闭合环状结构的非编码RNA,无5’帽和3’尾,比线性RNA更稳定(不易被RNA外切酶降解),且具有组织特异性和细胞定位特异性。早期研究认为circRNA是pre-mRNA剪接的“副产物”,无功能;但随着高通量测序和生物信息学技术的发展,发现circRNA可通过miRNA海绵(ceRNA机制)、调控转录、翻译功能蛋白、结合RNA结合蛋白(RBP)等多种方式调控基因表达,参与肿瘤增殖、转移、耐药等过程。近年来,越来越多研究表明circRNA在ESCC中差异表达,有望成为ESCC的诊断、预后生物标志物及治疗靶点。但目前研究仍存在不足:①机制研究多集中在miRNA海绵,结合蛋白和翻译功能的探索较少;②临床验证样本量小,缺乏多中心数据;③治疗策略的安全性和靶向性需优化。
本综述系统总结了circRNA在ESCC中的生物发生、功能机制、临床应用及未来方向,旨在为ESCC的精准诊疗提供理论依据。
2. 文献综述解析
核心评述逻辑
作者以“circRNA基础研究→ESCC应用研究→临床转化”为脉络,按“生物发生→功能→ESCC中的差异表达→调控机制(增殖、转移、耐药、细胞死亡)→临床应用(诊断、预后、治疗)→挑战与展望”组织内容,全面覆盖circRNA在ESCC中的研究全景。
现有研究总结
- circRNA的生物发生与功能:circRNA由pre-mRNA通过套索驱动、内含子配对、RBP驱动、内含子环化等方式生成(图1),转录速率、内含子互补序列(如ALU重复)、RBP(如MBL、QKI)等因素影响其表达。其功能包括:①miRNA海绵(如ciRS-7结合73个miR-7位点);②调控转录(如circEIF3J通过U1 snRNP增强宿主基因转录);③翻译蛋白(如circ-ZNF609通过IRES启动翻译);④结合RBP(如circACTN4结合FUBP1调控MYC表达)。
- ESCC中的差异circRNA:通过circRNA芯片(高效但仅检测已知circRNA)或RNA-seq(发现新circRNA但有效读段<0.1%),研究发现ESCC组织/血浆中存在大量差异circRNA(如Song等用6对组织筛选出2046个差异circRNA,其中1148个上调、898个下调)。
- 调控ESCC进展的机制:circRNA通过多种通路调控ESCC增殖(如circOGDH通过miR-615-5p/PDX1促进细胞周期)、转移(如circLPAR3通过miR-198/c-MET激活PI3K/AKT通路)、耐药(如circVRK1通过miR-624-3p/PTEN增强放疗敏感性)、细胞死亡(如circPVT1通过miR-30a-5p/FZD3抑制铁死亡)。
- 临床应用潜力:circRNA作为非侵入性生物标志物(如血浆circ-SLC7A5 AUC=0.77)或组织标志物(如circ-SMAD7 AUC=0.86)具有诊断价值;部分circRNA与临床特征(如淋巴结转移、OS)相关(如hsa_circ_0026611预测淋巴结转移);治疗方面,ASO、CRISPR/Cas13等技术可靶向circRNA(如circPDE3B knockdown减少肿瘤生长)。
综述创新点
- 机制覆盖全面:首次系统总结了circRNA在ESCC中的细胞死亡机制(铁死亡、焦亡)和耐药机制,填补了此前研究空白;
- 临床视角明确:重点讨论了circRNA作为联合诊断标志物的优势(如hsa_circ_0001946+hsa_circ_0062459 AUC=0.928),并提出治疗策略的优化方向(如CRISPR/Cas13的安全性评估);
- 未来方向清晰:指出需深入探索circRNA的翻译功能、开发新型检测技术(如单分子测序)、开展大样本多中心临床验证。
3. 研究思路总结与详细解析
本综述的研究思路围绕“基础→应用→转化”展开,具体环节如下:
3.1 circRNA的生物发生与功能概述
作者首先介绍circRNA的生成方式(图1),包括:①套索驱动环化(pre-mRNA形成套索结构,剪接为EcRNA/EIciRNA);②内含子配对环化(内含子互补序列结合驱动环化);③RBP驱动环化(如MBL结合内含子序列促进circMbl生成);④内含子环化(剪接后的内含子形成ciRNA);⑤tricRNAs(pre-tRNA经TSEN酶切形成)。随后阐述circRNA的四大功能(图2):miRNA海绵、调控转录、翻译蛋白、结合RBP。
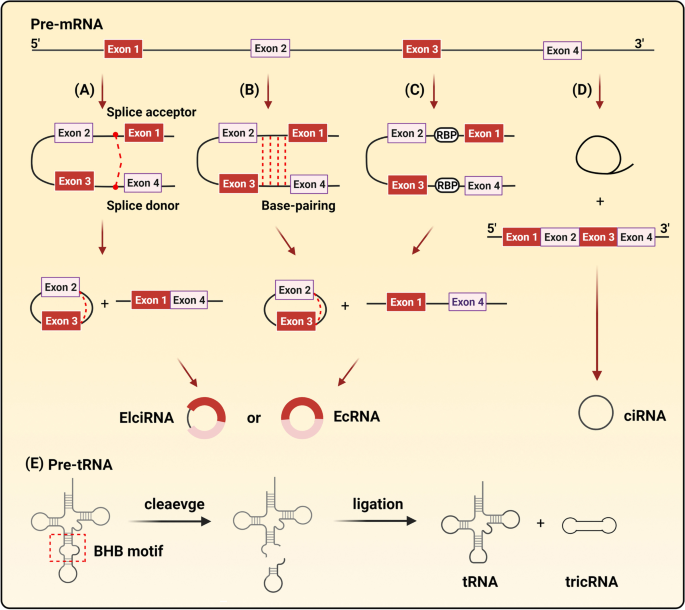
图1 circRNA的生物发生机制:A.套索驱动环化;B.内含子配对环化;C.RBP驱动环化;D.内含子环化;E.tricRNAs形成。

图2 circRNA的功能:A.核内调控转录;B.胞质miRNA海绵;C.结合RBP;D.翻译蛋白。
3.2 ESCC中差异circRNA的筛选
作者总结了多项高通量研究:①Song等用6对ESCC组织芯片筛选出2046个差异circRNA(1148个上调、898个下调);②Sun等用RNA-seq发现1055个差异circRNA(418个上调、637个下调);③Jiang等用RNA-seq发现3288个差异circRNA(2139个上调、1149个下调)。作者指出,circRNA芯片比RNA-seq更高效,但仅能检测已知circRNA;RNA-seq可发现新circRNA,但有效读段少。
3.3 circRNA调控ESCC增殖的机制
作者列举了多个关键circRNA:①circOGDH(高表达):通过miR-615-5p上调PDX1,促进细胞周期进展;②circNELL2(高表达):通过miR-127-5p上调CDC6(DNA复制关键因子),促进增殖;③circ-ITCH(低表达):通过海绵miR-7/17/214上调ITCH,抑制Wnt/β-catenin通路,减少c-Myc表达;④circLAPR4(低表达):通过miR-1323上调PTEN,抑制PI3K/AKT通路。
3.4 circRNA调控ESCC转移的机制
circRNA主要通过EMT通路促进转移:①circLPAR3(高表达):通过miR-198上调c-MET,激活PI3K/AKT和RAS/MAPK通路;②circVRK1(低表达):通过miR-624-3p上调PTEN,抑制PI3K/AKT通路;③circ-NRIP1(高表达):通过miR-595上调SEMA4D,激活PI3K/AKT通路;④circ-DOCK5(低表达):通过海绵miR-627-3p上调TGFB2,抑制TGF-β/SMAD/ZEB1轴。此外,血清外泌体hsa_circ_0026611高表达与淋巴结转移相关,可作为转移预测标志物。

图3 circRNA在ESCC中的功能总结:参与增殖、转移、耐药、细胞死亡。
3.5 circRNA调控ESCC细胞死亡与耐药的机制
- 细胞死亡:①circ0120816(高表达):通过miR-1305上调TXNRD1,抑制凋亡(减少Cleaved PARP、Bax表达);②ciRS-7(高表达):通过miR-1299上调EGFR,抑制自噬;③circPVT1(高表达):通过miR-30a-5p上调FZD3,抑制铁死亡(增加GPX4/SLC7A11表达);④circPUM1(高表达):抑制焦亡,促进肿瘤生长。
- 耐药:①circVRK1:过表达增强放疗敏感性;②circ100367:激活Wnt3通路增强放疗抵抗;③circPSMC3:通过miR-10a-5p上调PTEN,增强吉非替尼敏感性;④circ_0006168:通过miR-194-5p上调JMJD1C,增强紫杉醇耐药。
3.6 circRNA的临床应用研究
作者讨论了circRNA作为诊断、预后、治疗靶点的潜力:
- 诊断:循环circRNA(如circ-SLC7A5 AUC=0.77、circ0004771 AUC=0.82)为非侵入性标志物,联合检测(hsa_circ_0001946+hsa_circ_0062459)AUC=0.928,敏感性84%、特异性98%;
- 预后:hsa_circ_0026611与OS相关,circGSK3β与CEA联合AUC=0.80,预测预后更准确;
- 治疗:①ASO/siRNA:靶向circRNA的反向剪接位点(如circPDE3B knockdown减少肿瘤生长);②CRISPR/Cas13:删除circRNA编码基因或ALU元件(更高效但需评估安全性);③合成miRNA海绵:如同时抑制miR-21和miR-93的circRNA(图4)。

图4 circRNA的治疗策略:knockdown(ASO/siRNA/CRISPR)、过表达、合成miRNA海绵。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本综述中的Biomarker为ESCC患者血清/血浆或组织中的circRNA,筛选验证逻辑为“高通量筛选→细胞功能验证→临床相关性分析”:①通过芯片/RNA-seq筛选差异circRNA;②qRT-PCR验证表达;③细胞实验(增殖、转移)验证功能;④临床样本分析(与TNM分期、OS的关系)评估价值。
研究过程与成果
- 循环circRNA(非侵入性)
- hsa_circ_0026611:血清外泌体中高表达,与T分期、N分期、术后放化疗相关,能预测淋巴结转移(未明确敏感性/特异性);
- circ-SLC7A5:血浆中高表达,AUC=0.77(诊断ESCC);
- circ0004771:血浆中高表达,AUC=0.82(诊断ESCC);
hsa_circ_0001946 + hsa_circ_0062459:联合检测血浆中的两个circRNA,AUC=0.928,敏感性84%、特异性98%,诊断效率优于单个标志物。
组织circRNA(侵入性)
- circ-SMAD7:组织/血浆中低表达,AUC=0.86(诊断ESCC);
- circGSK3β:组织中高表达,与CEA联合AUC=0.80(预测预后);
- hsa_circ_0006948:组织中高表达,与OS和淋巴结转移相关(预测转移)。
核心成果
- 诊断价值:循环circRNA作为非侵入性标志物,具有较高的AUC值(如联合检测AUC=0.928),解决了ESCC早期诊断的痛点;
- 预后价值:部分circRNA与临床特征强相关(如hsa_circ_0026611预测淋巴结转移),可用于风险分层;
- 创新性:首次提出联合circRNA检测策略,显著提高诊断效率;发现circRNA与铁死亡、焦亡的关联,为预后评估提供新靶点。
局限性
- 多数Biomarker的95% CI、样本量未明确(如circ-SLC7A5的样本量未提及);
- 缺乏纵向研究(如跟踪患者治疗后的circRNA变化);
- 检测方法未标准化(如外泌体分离、qRT-PCR引物设计)。
结论与展望
本综述系统总结了circRNA在ESCC中的研究进展,明确了其作为生物标志物和治疗靶点的潜力。未来研究需聚焦:①深入探索circRNA的翻译功能(如是否通过m6A修饰翻译蛋白);②开发单分子测序等新型检测技术,提高circRNA的检测灵敏度;③开展大样本多中心临床研究,验证Biomarker的有效性;④优化治疗策略(如靶向递送系统),提高CRISPR/Cas13的安全性。
随着研究的深入,circRNA有望成为ESCC精准诊疗的“新利器”。
