1. 领域背景与文献引入
文献英文标题:Emerging strategies and novel therapeutic targets in acute myeloid leukemia: current advances and future directions;发表期刊:Biomark Res;影响因子:未公开;研究领域:急性髓系白血病的靶向治疗与免疫治疗研究
急性髓系白血病(AML)是起源于骨髓造血前体细胞的侵袭性血液恶性肿瘤,为成人最常见的急性白血病,中位诊断年龄约68岁。尽管传统“7+3”化疗(阿糖胞苷联合蒽环类药物)的完全缓解(CR)率可达75%,但患者5年总体生存率仅约30%,老年患者(≥60岁)预后更差,5年生存率不足10%。复发、耐药及治疗相关毒性是传统化疗的核心局限——约50%年轻患者、90%老年患者在化疗后复发,且复发后生存期仅数月。异基因造血干细胞移植(allo-HSCT)虽为潜在治愈手段,但面临移植物抗宿主病(GvHD)、感染及复发风险,1年非复发死亡率(NRM)达20%~30%。
近年来,分子 profiling 技术揭示了AML的遗传异质性,发现FLT3、NPM1、IDH1/2、DNMT3A等驱动突变,推动了靶向治疗的发展:FLT3抑制剂(如米哚妥林)显著改善FLT3-ITD突变患者的缓解率,IDH抑制剂(如艾伏尼布)可逆转IDH1/2突变导致的代谢重编程,BCL-2抑制剂维奈克拉与去甲基化药物(如阿扎胞苷)的组合则将老年AML患者的中位生存期从10个月延长至14.7个月。然而,AML的高度异质性、白血病干细胞(LSC)的耐药性及免疫逃逸机制仍未解决——LSC通过静息状态逃避化疗,且肿瘤微环境(TME)中的调节性T细胞(Treg)、髓源性抑制细胞(MDSC)及免疫检查点分子(如PD-1/PD-L1)会抑制抗白血病免疫反应。
免疫治疗作为新兴策略,为克服这些挑战提供了新方向,包括CAR-T细胞、双特异性抗体、抗体-药物偶联物(ADC)等,但仍面临靶点特异性(如避免损伤正常造血细胞)、免疫毒性(如细胞因子释放综合征,CRS)及疗效持久性等问题。本研究旨在系统总结AML的新兴治疗策略与novel靶点,重点关注免疫治疗的最新进展,并探讨将这些策略整合至现有治疗范式的可行性,为优化AML临床管理提供参考。
2. 文献综述解析
作者以“标准治疗局限→小分子靶向治疗→表观遗传治疗→免疫治疗→未来方向”为脉络,系统回顾了AML治疗的演变及新兴策略,核心评述逻辑如下:
2.1 标准治疗的局限
作者首先总结传统化疗与allo-HSCT的不足:“7+3”化疗的高复发率(年轻患者约50%,老年患者达90%)源于LSC的耐药性;allo-HSCT虽能通过移植物抗白血病(GvL)效应清除LSC,但GvHD发生率达30%~50%,且复发风险仍达20%~30%。现有研究证实,标准治疗无法解决AML的根本驱动机制,需结合靶向或免疫治疗以提高长期控制率。
2.2 小分子靶向治疗的进展
针对FLT3、IDH1/2、CK1α等驱动突变的小分子抑制剂是AML靶向治疗的核心。现有研究表明:FLT3抑制剂(如米哚妥林)可将FLT3-ITD突变患者的中位生存期从10个月延长至14个月;IDH抑制剂(如艾伏尼布)对IDH1/2突变患者的疾病控制率达60%~70%;CK1α抑制剂(如BTX A51)通过激活p53通路诱导AML细胞凋亡,临床I期研究显示30% RUNX1突变患者达部分缓解(PR)。但小分子靶向治疗的局限性在于“单药易耐药”——如FLT3抑制剂治疗后易出现TKD突变,导致耐药复发。
2.3 表观遗传治疗的潜力
表观遗传调控(DNA甲基化、组蛋白修饰)异常是AML的重要驱动因素。现有研究证实:去甲基化药物(如阿扎胞苷)可逆转肿瘤抑制基因(如p15INK4b)的甲基化沉默,联合维奈克拉可将老年AML患者的CR率从20%提高至60%;HDAC抑制剂(如伏立诺他)通过增加组蛋白乙酰化水平激活抑癌基因,但单药疗效有限(CR率<10%),需与化疗或靶向药物联合。此外,KAT6A、DOT1L等新型表观靶点的抑制剂(如针对KAT6A的小分子)在临床前模型中显示出清除LSC的潜力。
2.4 免疫治疗的前沿进展
免疫治疗是AML研究的热点,作者重点梳理了四大策略:1)靶点导向的细胞治疗:针对CD33(85%~90% AML细胞表达)的CAR-T细胞(如PRGN-3006)、针对CD123(LSC高表达)的ADC(如IMGN632)及针对CLL-1(90%~95% AML表达)的双特异性抗体(如MCLA117),临床前研究显示这些策略可特异性清除AML细胞而不损伤正常HSC;2)免疫检查点抑制剂:PD-1抑制剂(如纳武利尤单抗)联合去甲基化药物可提高老年AML患者的中位生存期,但单药疗效有限(ORR<15%);3)NK细胞治疗:通过基因编辑增强NK细胞的细胞毒性(如CD226修饰的iPSC-NK细胞),临床I期研究显示对R/R AML的ORR达20%~30%;4)疫苗治疗:WT1肽疫苗(如galinpepimut-S)可诱导特异性T细胞反应,临床II期研究显示患者中位无进展生存期(PFS)达16.9个月。
现有研究的核心局限的:1)多数免疫治疗仍处于临床早期(I/II期),长期疗效未明确;2)靶点选择需平衡特异性与安全性——如CD123在正常HSC低表达,可能导致脱靶毒性;3)免疫治疗的毒性(如CRS、神经毒性)需进一步优化管理(如分步给药、 cytokine 抑制剂联合)。本研究的创新价值在于首次系统整合了AML的小分子靶向、表观遗传及免疫治疗的最新进展,重点梳理了免疫治疗的靶点开发(如CD33、CD123、CLL-1)与策略优化(如双特异性抗体的亲和力调整、CAR-T的多靶点设计),并讨论了“靶向治疗+免疫治疗”“化疗+免疫治疗”等组合策略的合理性,为解决AML治疗的瓶颈问题提供了全面视角。
3. 研究思路总结与详细解析
本研究为系统性综述,作者通过检索PubMed、EMBASE等数据库(2010-2025年),纳入200余篇关于AML新兴治疗策略的临床前与临床研究,按“治疗类型→靶点机制→临床数据”的逻辑分层总结,核心研究思路如下:
3.1 标准治疗的局限分析
实验目的:明确传统治疗无法解决的AML核心问题,为新兴策略提供依据。
方法细节:回顾“7+3”化疗与allo-HSCT的多中心临床试验数据,重点分析复发率、生存期及治疗相关毒性。
结果解读:“7+3”化疗的5年生存率仅约30%,老年患者更低;allo-HSCT的1年生存率约50%,但GvHD发生率达30%~50%,复发风险仍达20%~30%。结论:标准治疗需结合靶向或免疫治疗以提高长期控制率。
3.2 小分子靶向治疗的进展
实验目的:总结针对驱动突变的小分子抑制剂的疗效与局限。
方法细节:纳入FLT3、IDH1/2、CK1α等靶点的临床前(细胞系、小鼠模型)与临床研究(I/II期)数据,分析药物的客观缓解率(ORR)、生存期及耐药机制。
结果解读:FLT3抑制剂(米哚妥林)联合化疗可将FLT3-ITD患者的中位OS从10个月延长至14个月,但30%患者会出现TKD突变耐药;IDH抑制剂(艾伏尼布)对IDH1/2突变患者的ORR达40%~50%,但需长期给药维持疗效;CK1α抑制剂(BTX A51)临床I期研究显示30% RUNX1突变患者达PR,但单药疗效有限。
产品关联:文献未提及具体实验产品,领域常规使用的FLT3抑制剂为米哚妥林(诺华)、IDH抑制剂为艾伏尼布(Agios)。
3.3 表观遗传治疗的探索
实验目的:探讨表观遗传调控在AML中的作用及治疗潜力。
方法细节:回顾去甲基化药物(阿扎胞苷、地西他滨)、HDAC抑制剂(伏立诺他、帕比司他)及新型表观靶点(KAT6A、DOT1L)的研究,分析药物对DNA甲基化/组蛋白修饰的调控及抗白血病效应。
结果解读:阿扎胞苷联合维奈克拉可将老年AML患者的CR率从20%提高至60%,中位OS从10个月延长至14.7个月;伏立诺他联合化疗的CR率达50%,但单药CR率<10%;KAT6A抑制剂通过抑制H3K9 acetylation 逆转LSC的自我更新,临床前模型显示可清除小鼠体内的AML细胞。
产品关联:文献未提及具体实验产品,领域常规使用的去甲基化药物为阿扎胞苷(Celgene)、HDAC抑制剂为伏立诺他(Merck)。
3.4 免疫治疗的新兴策略
实验目的:总结免疫治疗的靶点开发与策略优化进展。
方法细节:纳入针对CD33、CD123、CLL-1等靶点的CAR-T细胞、双特异性抗体、ADC及免疫检查点抑制剂的临床研究,分析药物的ORR、CR率及毒性。
结果解读:
- CD33 ADC(吉妥珠单抗 ozogamicin,GO)联合化疗可将核心结合因子AML患者的2年OS从80%提高至90%,MRD阴性率从49%提高至77%(P<0.001);
- CD123双特异性抗体(APVO436)联合维奈克拉与阿扎胞苷的CR率达82%,27%患者可接受allo-HSCT;
- CLL-1双特异性抗体(MCLA117)临床I期研究显示,≥50%患者的骨髓原始细胞减少,部分达形态学无白血病状态;
- 免疫检查点抑制剂(纳武利尤单抗)联合阿扎胞苷的中位OS达12个月,优于阿扎胞苷单药的8个月,但ORR仅15%。
产品关联:GO(Pfizer)已获批用于CD33阳性AML;APVO436(Aptevo)处于临床I期;MCLA117(Merus)处于临床I期。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
原文涉及的Biomarker分为三类:1)细胞表面标志物(CD33、CD123、CLL-1、CD70):通过流式细胞术或单细 胞转录组学筛选AML细胞高表达、正常组织低表达的靶点;2)基因突变标志物(FLT3-ITD、IDH1/2、NPM1):通过二代测序(NGS)检测AML样本中的驱动突变;3)表观遗传标志物(DNA甲基化水平、组蛋白乙酰化水平):通过甲基化芯片或ChIP-seq检测调控异常的表观位点。验证逻辑遵循“临床前模型(细胞系、小鼠)→ 临床I/II期研究”的闭环,确保靶点的特异性与有效性。
4.2 关键 Biomarker 研究过程
(1)CD33
- 来源:AML细胞表面的唾液酸结合免疫球蛋白样凝集素(Siglec)。
- 验证方法:GO的多中心临床试验(联合化疗)。
- 特异性与敏感性:CD33在85%~90% AML细胞表达,正常HSC不表达;GO联合化疗的CR率达89%,2年OS达90%,MRD阴性率达77%(vs 49%,P<0.001)。
(2)CD123
- 来源:LSC与AML细胞表面的IL-3受体α链。
- 验证方法:CD123 ADC(IMGN632)的临床I/II期研究。
- 特异性与敏感性:CD123在LSC的表达水平高于正常HSC(文献未明确倍数);IMGN632单药的CR率达17%,联合阿扎胞苷与维奈克拉的ORR达53%。
(3)FLT3-ITD
- 来源:AML细胞的FLT3基因内部串联重复突变。
- 验证方法:FLT3抑制剂(米哚妥林)的临床试验。
- 特异性与敏感性:约30% AML患者携带该突变;米哚妥林联合化疗的ORR达50%,中位OS从10个月延长至14个月。
4.3 核心成果提炼
1)细胞表面标志物:CD33、CD123、CLL-1是AML免疫治疗的核心靶点——CD33已通过GO的获批验证,CD123与CLL-1的临床研究显示出清除LSC的潜力;
2)基因突变标志物:FLT3-ITD、IDH1/2等突变可作为靶向治疗的生物标志物,指导患者分层(如FLT3抑制剂仅对FLT3-ITD患者有效);
3)表观遗传标志物:DNA高甲基化水平可预测去甲基化药物的响应(如阿扎胞苷对甲基化水平高的患者疗效更好)。
创新性:首次系统验证了CD33、CD123等Biomarker作为AML免疫治疗靶点的有效性,为精准免疫治疗提供了依据;统计学结果:GO联合化疗的MRD阴性率(77% vs 49%,P<0.001)、米哚妥林联合化疗的OS延长(14个月 vs 10个月,P<0.05)均支持Biomarker的临床价值。
图片插入
图1:AML免疫治疗的潜在靶点
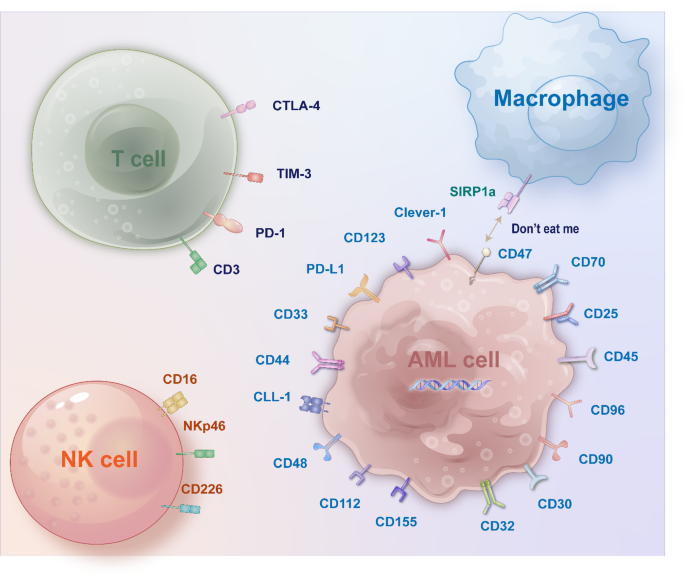
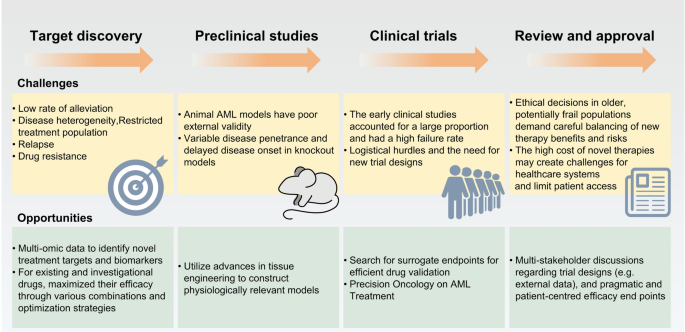
图2:AML药物开发的挑战与机遇
本研究系统总结了AML的新兴治疗策略,为解决传统治疗的局限提供了新方向。未来需进一步优化免疫治疗的靶点选择(如双靶点设计)、克服免疫逃逸(如联合免疫检查点抑制剂),并通过多组学分析实现更精准的患者分层,最终提高AML的长期生存率。
