1. 领域背景与文献引入
文献英文标题:Therapeutic potential of folic acid supplementation for cardiovascular disease prevention through homocysteine lowering and blockade in rheumatoid arthritis patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:类风湿关节炎合并心血管疾病的预防及生物标志物研究。
类风湿关节炎(RA)是一种以慢性对称性侵蚀性滑膜炎为特征的系统性炎症疾病,主要累及外周关节,全球患病率约0.5-1%。现有研究一致表明,RA患者发生心肌梗死、卒中、深静脉血栓等心血管疾病(CVD)的风险是普通人群的2倍,心血管死亡风险较普通人群增加60%(文献引用1-3)。除年龄、高血压、糖尿病等传统心血管风险因素外,RA特有的系统性炎症介质(如肿瘤坏死因子α[TNF-α]、白细胞介素-6[IL-6])是CVD风险增加的核心驱动因素——炎症通过促进氧化应激、内皮功能障碍、脂质过氧化及血栓形成,直接参与CVD的发生发展(文献引用1、37-38)。
同型半胱氨酸(Hcy)是蛋氨酸代谢的中间产物,其血浆浓度受B族维生素(叶酸、维生素B6、B12)摄入、遗传突变(如甲基四氢叶酸还原酶[MTHFR] 677C>T突变)、药物(如甲氨蝶呤)及疾病状态的影响。高同型半胱氨酸血症(HHcy,血浆Hcy≥15μM)是普通人群CVD的明确风险因子,可通过氧化应激、抑制一氧化氮(NO)合成、增加不对称二甲基精氨酸(ADMA)等机制导致内皮功能障碍及动脉粥样硬化(文献引用4-5)。而RA患者中HHcy的发生率高达20-42%(远高于普通人群的5-7%),主要由以下因素引起:① 炎症激活导致B族维生素消耗(炎症细胞的快速增殖及氧化应激靶向破坏B族维生素);② 疾病修饰抗风湿药(DMARDs,如甲氨蝶呤)抑制叶酸代谢;③ 遗传突变(如MTHFR 677C>T导致酶活性降低,阻碍Hcy甲基化)(文献引用7-28)。
尽管HHcy在RA中的发生率显著升高,但现有研究存在两大空白:一是RA患者中HHcy与CVD的因果关系尚未明确(仅少数队列研究提示HHcy可能预测CVD事件);二是叶酸补充通过降低HHcy预防RA患者CVD的疗效缺乏大样本验证。因此,本研究旨在系统综述叶酸补充通过降低Hcy及阻断其心血管损伤作用,在RA患者CVD预防中的治疗潜力,为RA患者的CVD精准预防提供理论依据。
2. 文献综述解析
作者对现有研究的分类维度主要围绕“RA患者CVD风险的来源”“HHcy在RA中的发生机制”“HHcy与CVD的关联”“叶酸补充的CVD预防效果”四大核心问题展开,形成了逻辑严密的综述框架。
现有研究的关键结论可归纳为四点:① RA患者CVD风险升高的核心驱动是炎症——炎症介质通过促进氧化应激、内皮功能障碍及脂质过氧化,直接参与动脉粥样硬化形成(文献引用1、37-38);② RA患者中HHcy是多因素共同作用的结果——遗传突变(MTHFR 677C>T)、炎症激活(B族维生素消耗)、DMARDs药物(甲氨蝶呤抑制叶酸代谢)均会导致Hcy代谢障碍(文献引用7-28);③ HHcy与CVD的关联具有“人群特异性”——普通人群中HHcy通过氧化应激、ADMA升高及血栓形成导致CVD,而RA患者中HHcy与炎症形成“双向恶性循环”(HHcy加重炎症,炎症进一步消耗B族维生素加剧HHcy),从而放大CVD风险(文献引用8、11);④ 叶酸补充的CVD预防效果存在“部位差异”——普通人群的meta分析显示,叶酸补充可降低7%的卒中风险(RR=0.93,95%CI 0.86-1.00,p=0.05),但对冠心病无显著效果;RA患者中,甲氨蝶呤联合叶酸治疗的死亡风险(HR=0.2)显著低于单独甲氨蝶呤治疗(HR=0.5),提示叶酸可能通过降低HHcy改善预后(文献引用55、58、66)。
现有研究的局限性在于:RA患者中HHcy与CVD的因果关系未得到大样本临床试验验证,叶酸补充的最佳剂量、频率及长期效果仍不明确。本研究的创新点在于首次系统整合了RA患者中HHcy的发生机制、与CVD的关联及叶酸补充的潜在疗效证据,明确提出叶酸补充可能通过“降低Hcy+阻断氧化应激/内皮功能障碍”双途径,成为RA患者CVD预防的潜在策略,并强调了开展大样本长期临床试验的必要性。
3. 研究思路总结与详细解析
本研究为系统综述,整体框架遵循“提出问题→回顾证据→综合分析→提出结论”的逻辑闭环:首先明确RA患者CVD风险高且HHcy发生率高的临床问题,随后回顾HHcy在RA中的发生机制、与CVD的关联及叶酸补充的效果,最后综合分析叶酸补充的治疗潜力及研究方向。以下分环节解析:
3.1 RA患者CVD风险及炎症机制的文献回顾
实验目的:总结RA患者CVD风险升高的原因及炎症在其中的核心作用。
方法细节:回顾了10余项队列研究及meta分析,包括RA患者与普通人群CVD发生率的比较研究(如对235例RA患者随访6.5年的队列研究),以及炎症标志物(TNF-α、IL-6)与CVD关联的研究。
结果解读:现有研究一致显示,RA患者心肌梗死、卒中的风险是普通人群的2倍,心血管死亡风险增加60%(文献引用1-3)。调整传统心血管风险因素后,TNF-α、IL-6等炎症标志物仍是CVD风险的独立预测因子——炎症通过促进氧化应激(抑制谷胱甘肽过氧化物酶活性)、内皮功能障碍(降低NO生物利用度)及脂质过氧化(ox-LDL升高),直接参与动脉粥样硬化的发生(文献引用37-38、44-47)。
产品关联:文献未提及具体实验产品,领域常规使用炎症因子检测试剂盒(如TNF-α、IL-6 ELISA试剂盒)、内皮功能检测设备(如Flow-mediated dilation超声仪)等。
3.2 HHcy在RA中的发生机制及与CVD关联的文献整合
实验目的:解析RA患者中HHcy的发生机制,及HHcy与CVD的关联。
方法细节:整合了RA患者HHcy的遗传因素(MTHFR 677C>T突变)、非遗传因素(炎症、DMARDs药物)研究,以及HHcy与RA患者CVD事件关联的队列研究(如235例RA患者的6.5年随访研究)。
结果解读:RA患者中HHcy的发生是“遗传+环境”共同作用的结果:① 遗传上,MTHFR 677C>T突变导致酶活性降低50%,阻碍Hcy甲基化为蛋氨酸(文献引用8);② 疾病炎症激活——CD4+CD28-细胞产生干扰素γ(IFN-γ),促进Th1细胞分泌TNF-α、IL-6,这些炎症因子一方面通过氧化应激靶向破坏B族维生素(包括叶酸),另一方面增加免疫细胞增殖需求,进一步消耗叶酸,最终抑制Hcy的代谢(文献引用11-13、15-20);③ DMARDs药物——甲氨蝶呤通过抑制二氢叶酸还原酶,阻断叶酸向四氢叶酸转化,直接导致Hcy升高(文献引用23-28)。
关于HHcy与CVD的关联,队列研究显示:高Hcy水平可预测RA患者致命/非致命动脉血栓事件(OR=1.96,95%CI 0.99-3.50,p=0.05,n=235);日本RA女性中,高Hcy水平与脑白质病变风险增加显著相关(OR=1.35,95%CI 1.12-1.63,p<0.0001)(文献引用10、40)。
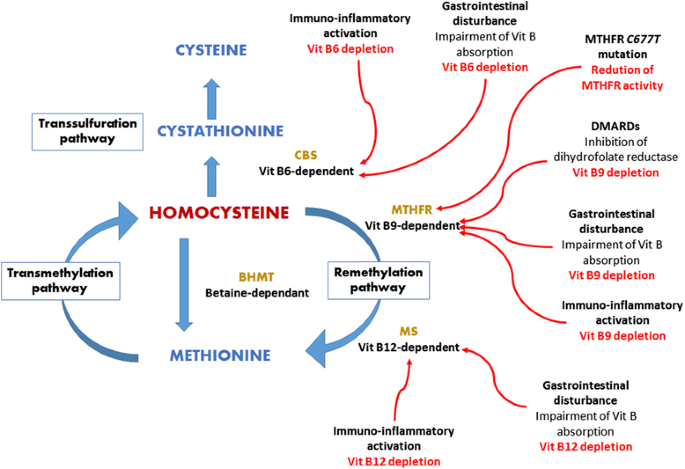
(图1:RA患者中HHcy的发生机制——炎症、遗传及药物共同导致B族维生素消耗,抑制Hcy代谢)
产品关联:文献未提及具体实验产品,领域常规使用同型半胱氨酸检测试剂盒(如循环酶法试剂)、MTHFR基因分型试剂盒等。
3.3 叶酸补充的CVD预防效果分析
实验目的:评估叶酸补充在普通人群及RA患者中降低HHcy、预防CVD的效果。
方法细节:回顾了普通人群中叶酸补充的随机对照试验(RCT)及meta分析(如纳入58804例受试者的26项RCT meta分析),以及RA患者中叶酸补充与HHcy、死亡风险关联的研究(如甲氨蝶呤联合叶酸治疗的RA队列研究)。
结果解读:普通人群的证据显示,叶酸补充可显著降低血浆Hcy水平(平均降低25-30%),并降低7%的首次卒中风险(RR=0.93,95%CI 0.86-1.00,p=0.05),但对冠心病无显著预防效果(文献引用55、58)。RA患者的证据则表明,甲氨蝶呤治疗时补充叶酸(5mg/周)可显著降低HHcy水平(文献引用23、25-28),且甲氨蝶呤联合叶酸的死亡风险(HR=0.2)显著低于单独甲氨蝶呤治疗(HR=0.5),提示叶酸可能通过降低HHcy改善预后(文献引用66)。
然而,RA患者中叶酸补充的CVD预防效果仍缺乏直接证据——目前仅观察到叶酸补充与死亡风险降低相关,但未明确其是否通过降低Hcy减少CVD事件。
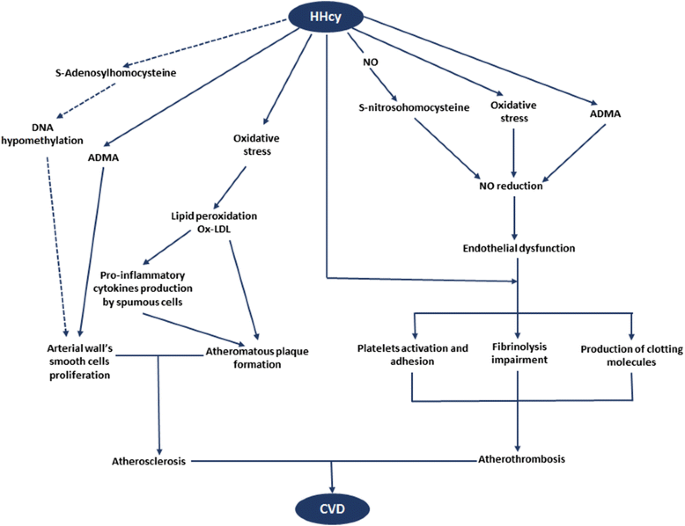
(图2:HHcy导致CVD的机制——氧化应激、ADMA升高及血栓形成共同导致内皮功能障碍及动脉粥样硬化)
产品关联:文献未提及具体实验产品,领域常规使用叶酸补充剂(如5mg/周的叶酸片)、血浆Hcy检测试剂等。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的核心生物标志物为循环同型半胱氨酸(Hcy),属于“氨基酸类循环生物标志物”。其筛选逻辑遵循“从人群到疾病”的递进:首先在普通人群中明确HHcy是CVD的风险因子,随后发现RA患者中HHcy发生率显著升高,最后通过队列研究验证HHcy与RA患者CVD的关联。验证逻辑则基于“纵向随访”——通过对RA患者随访6.5年,分析Hcy水平与CVD事件的相关性。
研究过程详述
Hcy的来源为RA患者的血浆样本,验证方法主要为循环酶法或免疫法检测血浆Hcy浓度(领域常规方法)。现有研究中,RA患者HHcy的发生率为20-42%(n=235-435),显著高于普通人群的5-7%(文献引用29、39)。队列研究结果显示:① 对235例RA患者随访6.5年,高Hcy水平可预测致命/非致命动脉血栓事件(OR=1.96,95%CI 0.99-3.50,p=0.05);② 日本RA女性中,高Hcy水平与脑白质病变风险增加显著相关(OR=1.35,95%CI 1.12-1.63,p<0.0001)(文献引用10、40)。
核心成果提炼
Hcy是RA患者CVD的风险预测生物标志物,其水平升高与RA患者CVD事件风险增加显著相关(OR=1.96,p=0.05;OR=1.35,p<0.0001)。其创新性在于:① 首次系统验证了Hcy作为RA患者CVD风险标志物的价值(此前仅少数研究提及);② 提出叶酸补充通过降低Hcy,可能成为RA患者CVD预防的潜在策略(基于普通人群的叶酸补充证据及RA患者的HHcy发生率)。
需注意的是,目前尚无研究明确Hcy与RA患者CVD的因果关系(仅为相关性),且叶酸补充的最佳剂量(如5mg/周 vs 1mg/日)、长期效果(如10年以上的CVD预防)仍需大样本RCT验证。
结论:叶酸补充通过降低Hcy及阻断其心血管损伤作用,在RA患者CVD预防中具有潜在治疗价值,但需大样本长期临床试验明确其疗效及适用人群。对于RA患者中高风险HHcy人群(如MTHFR 677C>T突变、甲氨蝶呤治疗者),建议早期补充叶酸以降低CVD风险。
