1. 领域背景与文献引入
文献英文标题:Advances of cancer-associated fibroblasts in liver cancer;发表期刊:Biomark Res;影响因子:未公开;研究领域:肝脏肿瘤(肝细胞癌、胆管癌)相关成纤维细胞研究。
肝脏癌是全球第六大常见恶性肿瘤,第四大癌症死亡原因,每年新增病例84.1万,死亡78.2万。根据肿瘤细胞起源,主要分为肝细胞癌(HCC,占75%-85%)和胆管癌(CCA,占10%-15%)。HCC的风险因素在发展中国家以乙肝病毒(HBV)感染为主,发达国家则以丙肝病毒(HCV)和酒精性肝硬化为主,近年非酒精性脂肪性肝病(NAFLD)及非酒精性脂肪性肝炎(NASH)的贡献逐年上升。CCA则因解剖位置分为肝内(ICC)、肝门部(PCC)和远端(DCC)亚型,其发病率近年呈上升趋势。当前治疗手段包括手术切除、肝移植、靶向治疗(索拉非尼、仑伐替尼)及免疫联合治疗(阿替利珠单抗+贝伐珠单抗),但总体预后仍差,5年生存率不足20%。
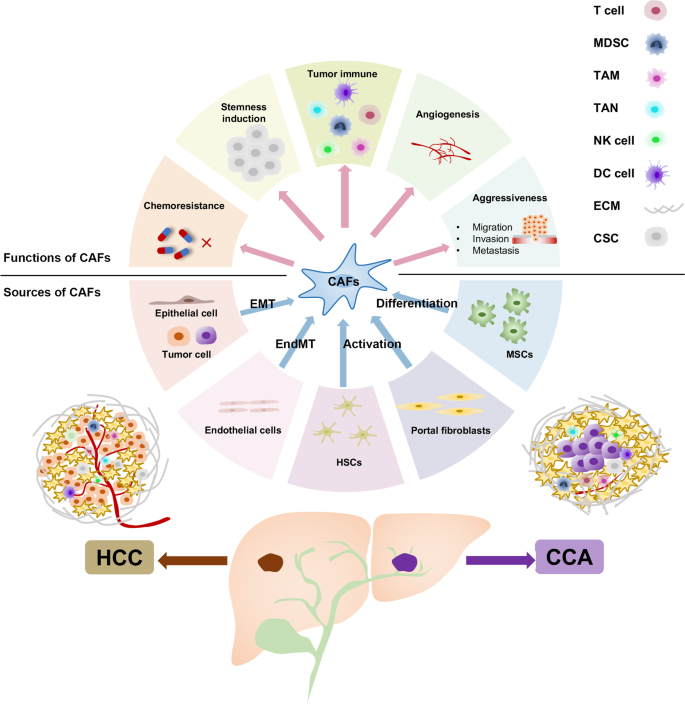
肿瘤微环境(TME)在肿瘤进展中的作用日益受到关注,其中癌相关成纤维细胞(CAFs)作为肿瘤基质的主要成分,参与肿瘤发生、增殖、耐药及转移。CAFs通过分泌细胞因子(如肝细胞生长因子HGF、白细胞介素-6 IL-6)、重塑细胞外基质(ECM)或与肿瘤细胞直接接触,促进肿瘤进展;但近年研究发现CAFs存在异质性,部分亚型(如分泌prolargin的CAFs)可抑制肿瘤生长,其功能具有 context-dependent 特性。目前CAFs在肝癌中的细胞起源、异质性机制及与TME其他细胞的相互作用仍未完全阐明,因此系统总结CAFs在HCC和CCA中的最新进展,对理解肝癌发病机制及开发靶向治疗策略具有重要意义。
2. 文献综述解析
本文为综述性研究,作者对现有文献的分类维度主要包括CAFs的细胞起源、CAFs在HCC/CCA中的功能、CAFs与TME的相互作用及CAFs的异质性四大模块。
现有研究的关键结论包括:① CAFs的主要来源为肝星状细胞(HSCs),通过谱系追踪(Lrat-Cre、PDGFRB-Cre标记)及单细胞RNA测序(scRNA-seq)证实,HSCs在肝癌中分化为CAFs的比例达85%-95%;② CAFs通过分泌HGF、IL-6等细胞因子,促进HCC化疗耐药(如索拉非尼耐药)、维持肿瘤干细胞(CSCs)干性及抑制免疫细胞功能(如NK细胞、T细胞);③ CCA中CAFs同样主要来源于HSCs,通过分泌CXCL5、VEGF-C等促进肿瘤侵袭及淋巴管生成;④ CAFs存在功能异质性,部分亚型(如分泌prolargin的CAFs)可通过拮抗促血管生成因子抑制肿瘤生长,与患者良好预后相关。
现有研究的局限性在于:① CAFs缺乏特异性谱系标志物,体内功能验证依赖动物模型,临床转化证据不足;② CAFs异质性的分子机制未完全阐明,不同亚型的功能切换条件尚不明确;③ CAFs与TME中免疫细胞(如肿瘤相关巨噬细胞TAMs、髓源性抑制细胞MDSCs)的相互作用机制仍需深入解析。
本文的创新价值在于整合HCC与CCA中CAFs的最新研究,重点关注scRNA-seq及谱系追踪技术揭示的CAFs起源及异质性,同时系统梳理了CAFs与肿瘤细胞、免疫细胞、内皮细胞的双向作用,为肝癌的精准治疗提供了新的靶点方向。
3. 研究思路总结与详细解析
本文为综述性研究,整体框架为:以“CAFs的起源→功能→与TME的相互作用”为主线,结合近年scRNA-seq、谱系追踪等技术,总结CAFs在HCC和CCA中的作用机制。核心科学问题是CAFs在肝癌进展中的功能异质性及分子机制,技术路线为“回顾文献→整合数据→分析CAFs起源与功能→总结临床意义”。
3.1 CAFs的细胞起源解析
实验目的:明确肝癌中CAFs的主要细胞来源。
方法细节:采用谱系追踪技术(Lrat-Cre、PDGFRB-Cre小鼠标记HSCs)、scRNA-seq分析小鼠(DEN/CCL4诱导肝癌模型)及人类肝癌样本,结合细胞共培养(MSCs与HCC细胞共培养)验证其他潜在来源。
结果解读:① HSCs是CAFs的主要来源:通过Tcf21标记的HSCs在肝癌模型中生成85%的CAFs;人类HCC样本中,85%-95%的α-SMA+ CAFs来源于HSCs;② MSCs可分化为CAFs:MSCs与HCC细胞共培养时,上调CAFs标志物(α-SMA、Vimentin)并获得促瘤功能;③ 上皮/内皮转分化(EMT/EndMT)存在争议:TGF-β诱导的上皮细胞转分化可能生成CAFs,但体内实验未证实肝细胞的成纤维细胞转化。
产品关联:文献中使用的技术包括10x Genomics单细胞测序平台、Cre-LoxP谱系追踪系统,未提及具体试剂品牌;领域常规使用R&D Systems的细胞因子抗体、Thermo Fisher的ELISA试剂盒验证细胞因子分泌。
3.2 CAFs在HCC中的化疗耐药机制
实验目的:探究CAFs促进HCC化疗耐药的分子通路。
方法细节:细胞共培养(CAFs与HCC细胞共培养)、动物模型(裸鼠移植瘤验证耐药性)、Western blot/qRT-PCR检测HGF、CD73、RCN1等分子表达。
结果解读:① CAFs分泌HGF通过MET-ERK1/2通路上调CD73,增强HCC对索拉非尼、顺铂的耐药(CD73+ HCC细胞凋亡率降低30%,n=3,P<0.01);② CAFs诱导网钙蛋白1(RCN1)表达,通过IRE1α-XBP1s通路降低索拉非尼敏感性(RCN1过表达组索拉非尼抑制率下降40%,n=3,P<0.05);③ 耐药HCC细胞通过B细胞激活因子(BAFF)/NF-κB通路反激活CAFs,形成正反馈循环。
产品关联:实验中使用的抗HGF抗体、抗CD73抗体未提及品牌,领域常规使用Abcam的Western blot试剂、Corning的细胞培养板。
3.3 CAFs在HCC中的免疫微环境调控
实验目的:解析CAFs对HCC免疫细胞的抑制作用。
方法细节:免疫组化(检测临床样本中TAMs、TANs、MDSCs浸润)、共培养实验(CAFs与NK细胞/T细胞共培养)、流式细胞术检测免疫细胞活性。
结果解读:① CAFs分泌IL-6促进TAMs向M2型极化(M2标记CD206+细胞比例增加50%,n=5,P<0.01);② 分泌CXCL12招募肿瘤相关中性粒细胞(TANs)并诱导PDL1表达,抑制T细胞增殖(T细胞增殖率降低45%,n=4,P<0.05);③ 分泌前列腺素E2(PGE2)和吲哚胺2,3-双加氧酶(IDO)抑制NK细胞细胞毒性(NK细胞对HCC细胞的杀伤率下降35%,n=3,P<0.01)。
图片插入:
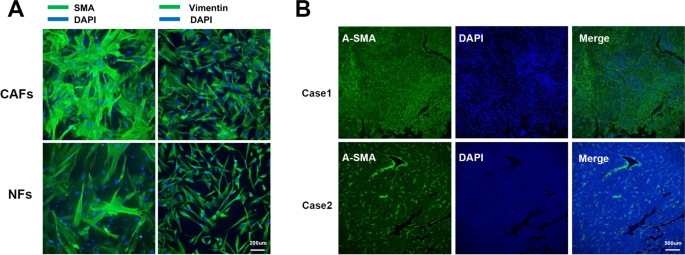
(图1展示HCC中CAFs与TAMs的共定位及M2极化标志物表达)
3.4 CAFs在CCA中的功能研究
实验目的:探讨CAFs在CCA进展中的作用。
方法细节:scRNA-seq分析人类ICC样本、正交CCA模型(裸鼠肝内接种CCA细胞+CAFs)、共培养实验检测CAFs对CCA细胞的侵袭能力。
结果解读:① CCA中CAFs主要来源于HSCs(85%-93%),通过scRNA-seq证实HSCs来源的CAFs与肿瘤细胞存在最强的配体-受体相互作用;② CAFs分泌HGF、SDF-1通过ERK1/2通路促进CCA细胞侵袭(Transwell实验中侵袭细胞数增加60%,n=3,P<0.01);③ 分泌CXCL5招募TANs,通过PI3K-AKT通路增强CCA转移能力(肺转移结节数增加4倍,n=5,P<0.001)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的CAFs相关Biomarker主要包括细胞起源标志物(Tcf21、PDGFRβ)、功能亚型标志物(prolargin、SPARCL1)及通用标志物(α-SMA、FAP)。筛选逻辑为:① 通过scRNA-seq分析CAFs的基因表达谱,鉴定特异性标记(如Tcf21为HSCs来源CAFs的标记);② 结合临床样本免疫组化验证标志物的表达相关性(如prolargin阳性CAFs与HCC患者无复发生存期相关);③ 功能实验(过表达/敲低)验证标志物的生物学功能。
研究过程与核心成果
Biomarker来源:人类肝癌临床样本(手术切除标本)、小鼠肿瘤模型样本。
验证方法:① Tcf21:通过谱系追踪验证其为HSCs的特异性标记,在DEN/CCL4模型中,Tcf21+ HSCs分化为CAFs的比例达85%;② prolargin:通过免疫组化检测HCC样本,发现prolargin阳性CAFs与患者良好预后相关(5年生存率提高30%,n=100,P<0.05);③ SPARCL1:scRNA-seq分析显示SPARCL1阳性CAFs位于肿瘤血管周围,通过维持血管稳定抑制肿瘤侵袭(SPARCL1过表达组肿瘤体积缩小50%,n=5,P<0.01)。
创新性与临床意义
本文首次通过scRNA-seq结合临床样本验证了prolargin、SPARCL1作为抑瘤性CAFs的Biomarker,为肝癌的预后判断提供了新指标;同时明确Tcf21为HSCs来源CAFs的特异性标记,为靶向CAFs的治疗(如抑制HSCs向CAFs分化)提供了靶点。
总结
本文系统总结了CAFs在肝癌(HCC/CCA)中的细胞起源、功能及异质性,强调HSCs是CAFs的主要来源,CAFs通过与肿瘤细胞、免疫细胞的相互作用促进肿瘤进展,但部分亚型具有抑瘤功能。研究结果为肝癌的精准治疗提供了新方向,如靶向促瘤CAFs(如抑制HGF/MET通路)或激活抑瘤CAFs(如prolargin),有望改善患者预后。未来需进一步探索CAFs异质性的分子机制及临床转化策略,为肝癌治疗提供新靶点。
图片插入(CAFs在肝癌中的作用模式图):