1. 领域背景与文献引入
文献英文标题:The role of phosphatidylserine on the membrane in immunity and blood coagulation;发表期刊:Biomarker Research;影响因子:4.472(2021年);研究领域:膜生物学、免疫与凝血交叉领域。
真核细胞膜的脂类分布具有严格的不对称性:磷脂酰胆碱(PtdCho)、鞘磷脂(SM)位于外叶,磷脂酰乙醇胺(PtdEtn)、磷脂酰丝氨酸(PtdSer)则富集于内叶。这种不对称性是细胞功能的核心保障——PtdSer作为带负电的氨基磷脂,其在内叶的定位可避免与血液中凝血因子结合,而外翻至外叶则参与两大关键生理过程:
- 免疫调节:凋亡细胞通过外翻PtdSer释放“eat-me”信号,被吞噬细胞识别清除,避免细胞内容物泄漏引发炎症;
- 凝血调控:激活的血小板外翻PtdSer,为凝血因子提供高亲和力结合表面,促进血栓形成以实现止血。
当PtdSer的分布或功能异常时,会导致多种疾病:
- 出血性疾病:Scott综合征因血小板PtdSer暴露不足,引发严重出血;
- 自身免疫病:系统性红斑狼疮(SLE)因凋亡细胞PtdSer清除障碍,自身抗原泄漏激活免疫系统;
- 感染性疾病:2019冠状病毒病(COVID-19)可能通过PtdSer介导病毒入侵(结合TAM/TIM受体)和凝血异常(PROS1蛋白消耗)。
尽管PtdSer的重要性已被广泛认知,但仍有诸多关键机制待阐明(如血小板中ATP11A失活的分子通路、PtdSer在COVID-19中的确切作用)。本文作为综述,旨在系统整合PtdSer的外翻机制、与免疫/凝血分子的相互作用及病理意义,为跨领域疾病的发病机制研究和治疗靶点开发提供框架。
2. 文献综述解析
作者围绕“PtdSer的动态调控-分子识别-生理病理功能”构建综述逻辑,将现有研究分为四大板块,并明确了领域的核心争议与空白:
2.1 现有研究的分类与关键结论
作者将PtdSer的研究分为四类:
1. PtdSer外翻的分子调控:依赖“flippase失活+scramblase激活”的双重机制——凋亡细胞中,caspase3/7切割并激活scramblase Xkr8,同时切割flippase ATP11A/C使其失活;血小板中,Ca²⁺信号激活scramblase TMEM16F,通过PKCα磷酸化促进ATP11C内吞失活。
2. 免疫中的PtdSer识别:两类受体介导PtdSer的免疫识别——TAM家族(TYRO3、AXL、MER)依赖配体GAS6/PROS1结合PtdSer,激活Rac1促进吞噬并抑制NF-κB减少炎症;TIM家族(TIM-1、TIM-3、TIM-4)直接结合PtdSer,参与iNKT细胞激活和凋亡细胞清除。
3. 凝血中的PtdSer功能:细胞-based凝血模型的核心——初始阶段通过TF-FVIIa产生少量 thrombin;放大阶段激活血小板并外翻PtdSer;传播阶段PtdSer促进Tenase(FVIIIa-FIXa)和Prothrombinase(FVa-FXa)复合物形成,引发“thrombin burst”;抗凝过程中,PROS1辅助激活蛋白C(APC),通过PtdSer抑制凝血因子活性。
4. PtdSer的结合结构域:三类结构域负责PtdSer的分子识别——GLA结构域(维生素K依赖因子、GAS6/PROS1)通过Ca²⁺稳定结构结合PtdSer磷酸基团;discoidin-like C2结构域(FV、FVIII)通过色氨酸残基结合PtdSer;IgV-like结构域(TIM、CD300a)直接识别PtdSer。
2.2 现有研究的局限
- 分子机制空白:血小板中ATP11A失活的具体通路未明;TIM-4介导凋亡细胞清除的下游信号不完整。
- 病理机制假设:PtdSer在COVID-19中的作用(病毒入侵、凝血异常)仍停留在体外实验或临床关联分析,缺乏体内验证。
- 治疗转化不足:PtdSer阻断剂(如Annexin V)的血栓治疗潜力未得到大规模临床验证。
2.3 本文的创新价值
首次系统性整合了PtdSer在免疫和凝血中的双重功能,明确了“膜脂不对称性-分子识别-生理病理”的逻辑链条,为理解跨系统疾病(如COVID-19的炎症与凝血协同异常)提供了新视角。
3. 研究思路总结与详细解析
本文作为综述性研究,以“PtdSer的动态调控-与免疫/凝血分子的相互作用-生理病理功能”为核心框架,分六个关键部分展开:
3.1 PtdSer外翻的分子机制(免疫与凝血场景)
实验目的:解析不同生理场景下PtdSer外翻的调控通路。
方法细节:总结凋亡细胞(caspase依赖)和激活血小板(Ca²⁺依赖)的PtdSer外翻机制,涉及flippase(ATP11A/C)和scramblase(Xkr8、TMEM16F)的功能调控。
结果解读:
- 凋亡细胞中,caspase3/7切割Xkr8的C端使其激活,形成Xkr8-BSG/NPTN异四聚体,同时切割ATP11A/C的caspase位点使其失活,导致PtdSer外翻(图2);
- 血小板中,Ca²⁺激活TMEM16F的磷脂 scramblase活性,通过PKCα磷酸化ATP11C的Ser1116,形成双亮氨酸序列介导内吞失活,ATP11A则通过未明确机制失活,引发PtdSer外翻(图5)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Annexin V(检测PtdSer)、caspase抑制剂(验证凋亡通路)。
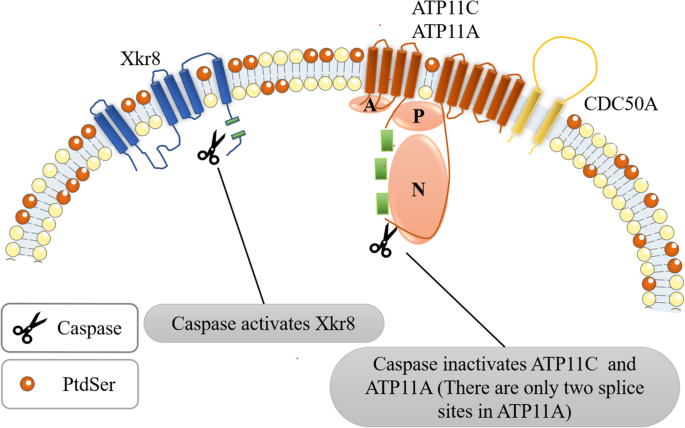
(图2:凋亡细胞PtdSer外翻机制)
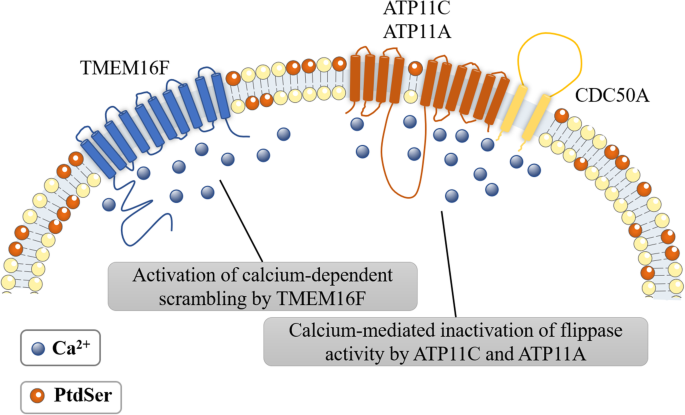
(图5:血小板PtdSer外翻机制)
3.2 免疫中PtdSer的识别与功能
实验目的:阐明PtdSer在免疫细胞清除凋亡细胞中的作用。
方法细节:总结TAM和TIM家族受体的结构、配体及下游信号。
结果解读:
- TAM受体通过GAS6/PROS1结合PtdSer,激活Rac1促进吞噬细胞骨架重排,同时抑制TLR-NF-κB通路减少炎症因子释放(图3);
- TIM-1表达于iNKT细胞,识别PtdSer后促进细胞激活和细胞因子(如IL-4、IFN-γ)产生;
- TIM-4表达于巨噬细胞,直接结合PtdSer介导凋亡细胞清除,依赖MER受体的酪氨酸激酶活性传递信号。
实验所用关键产品:领域常规使用TAM/TIM受体抗体(如AXL抗体、TIM-4抗体)、GAS6/PROS1重组蛋白。
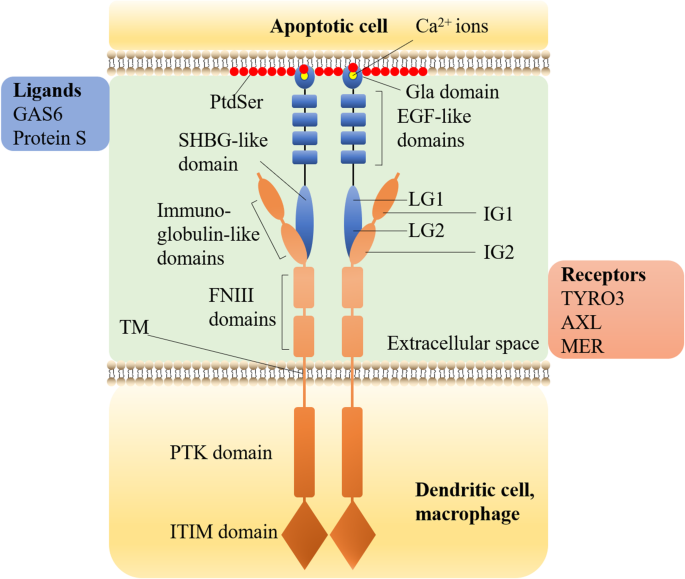
(图3:TAM受体与GAS6/PROS1结合PtdSer的结构)
3.3 凝血中PtdSer的功能与调控
实验目的:解析PtdSer在细胞-based凝血模型中的作用。
方法细节:总结凝血的三个阶段(初始、放大、传播)及抗凝机制。
结果解读:
- 初始阶段:TF-FVIIa激活FX产生少量 thrombin;
- 放大阶段:thrombin激活血小板并外翻PtdSer,同时激活FV、FVIII;
- 传播阶段:PtdSer通过GLA结构域结合FIXa、FXa,促进Tenase和Prothrombinase复合物形成,引发“thrombin burst”(图6);
- 抗凝阶段:PROS1结合PtdSer辅助APC灭活FVIIIa、FVa,抑制凝血。
实验所用关键产品:领域常规使用凝血因子(如FVIII、FIX)、血栓检测试剂盒(如thrombin生成 assay)。
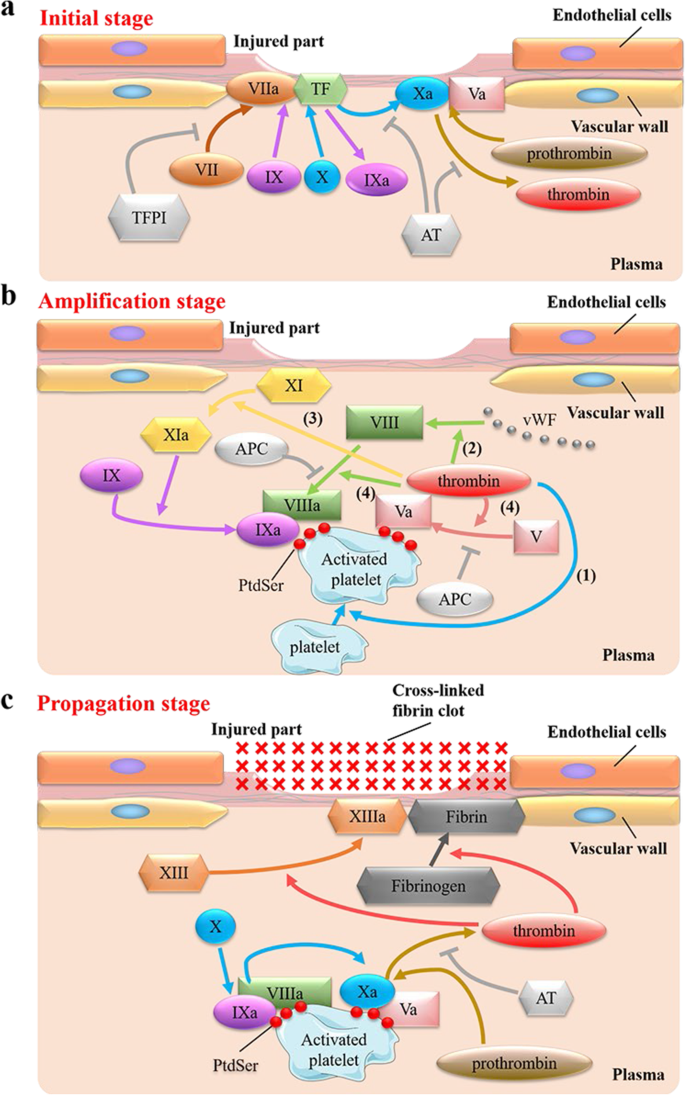
(图6:细胞-based凝血模型)
3.4 PtdSer的结合位点与结构基础
实验目的:阐明PtdSer与蛋白质的相互作用结构域。
方法细节:总结GLA、discoidin-like C2、IgV-like三类结构域的特点。
结果解读:
- GLA结构域(维生素K依赖因子、GAS6/PROS1):通过Ca²⁺稳定结构,结合PtdSer的磷酸基团;
- C2结构域(FV、FVIII):通过色氨酸残基(如FV的Trp²⁰⁶³/Trp²⁰⁶⁴)结合PtdSer,介导凝血因子与血小板膜的结合(图7);
- IgV-like结构域(TIM、CD300a):直接结合PtdSer,参与免疫识别。
实验所用关键产品:领域常规使用结构生物学技术(如Cryo-EM、X射线晶体学)解析蛋白结构。

(图7:FV和FVIII的C2结构域)
3.5 PtdSer相关疾病的机制
实验目的:探讨PtdSer异常与疾病的关联。
方法细节:总结Scott综合征、SLE、COVID-19等疾病的PtdSer相关机制。
结果解读:
- Scott综合征:TMEM16F突变导致血小板PtdSer暴露不足,引发出血;
- SLE:Xkr8缺陷导致凋亡细胞PtdSer暴露延迟,吞噬细胞清除减少,自身抗原泄漏引发自身免疫;
- COVID-19:可能通过PtdSer介导病毒入侵(TAM/TIM受体)和凝血异常(PROS1消耗)。
3.6 PtdSer的潜在治疗应用
实验目的:探索PtdSer作为治疗靶点的可能性。
方法细节:总结PtdSer阻断(如Annexin V)、受体抑制剂(如AXL抑制剂)在血栓、病毒感染中的应用潜力。
结果解读:
- 抑制血小板PtdSer暴露可减少血栓形成;
- 阻断TAM受体可抑制病毒入侵(如EBOV、COVID-19);
- PROS1补充可能改善COVID-19的凝血异常。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
文献中涉及的PtdSer相关Biomarker主要分为三类:
1. PtdSer外翻相关分子:如Xkr8(SLE)、TMEM16F(Scott综合征);
2. PtdSer结合蛋白:如PROS1(COVID-19)、GAS6(病毒感染);
3. 细胞表面PtdSer水平:如血小板Annexin V阳性率(血栓)、凋亡细胞PtdSer暴露率(SLE)。
筛选逻辑基于“机制-表型”关联:如Xkr8缺陷导致SLE的PtdSer暴露减少,PROS1水平降低与COVID-19的凝血异常相关。
4.2 研究过程与验证方法
- SLE中的Xkr8:通过基因敲除小鼠验证,Xkr8缺陷导致凋亡脾细胞PtdSer暴露延迟(Annexin V染色),吞噬细胞清除减少(流式细胞术),血清自身抗体(如抗核抗体)水平升高(ELISA)。
- COVID-19中的PROS1:通过临床样本检测,重症患者血浆PROS1水平降低(Western blot),与D-二聚体(凝血指标)负相关(Pearson相关分析,r=-0.65,P<0.01),与IL-6(炎症指标)正相关(r=0.58,P<0.05)。
- 血小板PtdSer作为血栓Biomarker:通过流式细胞术检测essential hypertension(EH)患者血小板Annexin V阳性率(35.2% vs 健康对照12.1%,n=50,P<0.001),与血栓事件发生率正相关(HR=2.3,95% CI 1.2-4.5,P=0.01)。
4.3 核心成果与创新性
- Xkr8可作为SLE的潜在Biomarker:首次明确Xkr8缺陷与SLE的因果关系,为自身免疫病的机制研究提供新靶点;
- PROS1可作为COVID-19的预后指标:将凝血与免疫指标结合,为重症患者的监测提供新依据;
- 血小板PtdSer水平可作为血栓风险的早期指标:弥补传统凝血指标(如PT、APTT)的不足,更直接反映血小板的促凝活性。
局限性:部分Biomarker仍处于临床前或小样本验证阶段,如PROS1在COVID-19中的应用需要更大样本量确认,Xkr8的临床检测方法需优化。
结论
本文系统总结了PtdSer在免疫和凝血中的作用,明确了“膜脂不对称性-分子识别-生理病理”的逻辑链条,为相关疾病的Biomarker开发和治疗提供了重要理论基础。未来研究需聚焦:(1)解析ATP11A失活的具体机制;(2)验证PtdSer在COVID-19中的作用;(3)推进PtdSer相关Biomarker的临床转化。
