1. 领域背景与文献引入
文献英文标题:Survival benefit and biomarker analysis of pyrotinib or pyrotinib plus capecitabine for patients with HER2-positive metastatic breast cancer: a pooled analysis of two phase I studies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:HER2阳性转移性乳腺癌靶向治疗。
HER2阳性乳腺癌约占所有乳腺癌的15%-20%,既往因肿瘤生物学行为侵袭性强,患者预后极差。自曲妥珠单抗等抗HER2靶向药物应用以来,HER2阳性乳腺癌的生存 outcomes显著改善——早期患者的复发风险降低50%以上,转移性患者的中位总生存期(OS)从1年延长至5年以上。然而,转移性HER2阳性乳腺癌仍面临两大挑战:一是一线治疗进展后的耐药问题,二是缺乏能预测靶向治疗疗效的生物标志物。
不可逆泛ErbB酪氨酸激酶抑制剂(TKI)如吡咯替尼的出现,为耐药患者提供了新选择。吡咯替尼能共价结合HER2、EGFR、HER4的激酶域,彻底阻断HER信号通路,前期Ⅰ期研究显示其单药客观缓解率(ORR)达50%,联合卡培他滨ORR更高达78.6%。但现有研究多关注短期疗效(如ORR、无进展生存期PFS),长期OS数据匮乏;且不同剂量吡咯替尼或联合方案的生存差异、以及与疗效相关的生物标志物尚未明确。本研究通过汇总两项Ⅰ期研究的个体患者数据,填补了吡咯替尼方案长期生存数据的空白,并探索了生物标志物,为HER2阳性转移性乳腺癌的精准治疗提供证据。
2. 文献综述解析
作者对现有研究的分类维度主要基于TKI作用机制(可逆vs不可逆)与治疗方案(单药vs联合化疗)。现有研究表明:可逆TKI(如拉帕替尼)因对HER家族抑制不完全,疗效有限;而不可逆泛ErbB TKI(如吡咯替尼、奈拉替尼)能更彻底阻断HER信号,展现更优抗肿瘤活性——例如吡咯替尼单药Ⅰ期研究的中位PFS为35.4周,联合卡培他滨的中位PFS达22.1个月。但现有研究的局限性在于:① 多数聚焦短期疗效,长期OS数据缺失;② 不同剂量或联合方案的生存差异未明确;③ 生物标志物研究多关注单一通路(如PI3K/Akt/mTOR),未综合分析多通路共突变的影响。
本研究的创新价值在于:首次汇总Ⅰ期研究的长期随访数据,明确了吡咯替尼方案的OS获益;首次通过ctDNA测序分析多通路共突变,为吡咯替尼的疗效预测提供了综合生物标志物,弥补了单一标志物的不足。
3. 研究思路总结与详细解析
本研究的核心目标是评估吡咯替尼单药/联合卡培他滨的长期生存获益,并探索与疗效相关的生物标志物;核心科学问题包括“吡咯替尼不同方案的生存差异”与“哪些生物标志物可预测吡咯替尼疗效”;技术路线为“汇总两项Ⅰ期研究个体数据→生存结局分析→ctDNA测序→生物标志物-生存关联”的闭环。
3.1 研究设计与患者纳入
实验目的是明确研究人群的代表性与入组标准的合理性。方法为汇总两项在中国国家癌症中心开展的Ⅰ期研究(NCT01937689:吡咯替尼单药;NCT02361112:吡咯替尼+卡培他滨)的个体数据,纳入标准包括HER2阳性转移性乳腺癌、ECOG 0-1、可测量病灶、无既往TKI治疗史;排除脑转移、既往卡培他滨耐药患者。结果显示,共纳入66例患者(单药组38例,联合组28例),中位年龄47.5岁,51.5%为激素受体(HR)阳性,80%有内脏转移,98.5%接受过紫杉类治疗,65.2%接受过曲妥珠单抗(其中62.8%用于转移性疾病)。两组基线特征无显著差异(图1为研究流程图)。
3.2 生存结局分析
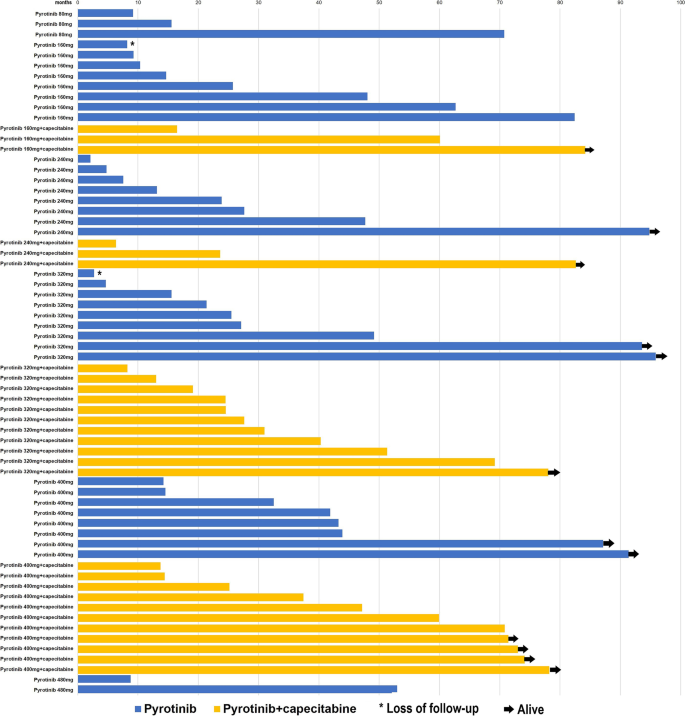
实验目的是评估吡咯替尼方案的长期生存获益及不同方案/剂量的差异。方法为采用Kaplan-Meier法估计PFS和OS,Cox模型计算风险比(HR),中位随访时间为OS 84.2个月(95% CI:74.7-93.7个月)。结果显示:总人群中位PFS为9.2个月(95% CI:5.4-12.9个月),中位OS为31.0个月(95% CI:16.5-45.5个月);联合组中位PFS(22.1个月)与OS(37.4个月)显著优于单药组(8.2个月、27.1个月);推荐剂量(400mg)组生存更优——单药400mg组中位OS 41.9个月,联合400mg组中位OS 59.9个月(图2为不同剂量组生存曲线)。
3.3 生物标志物分析
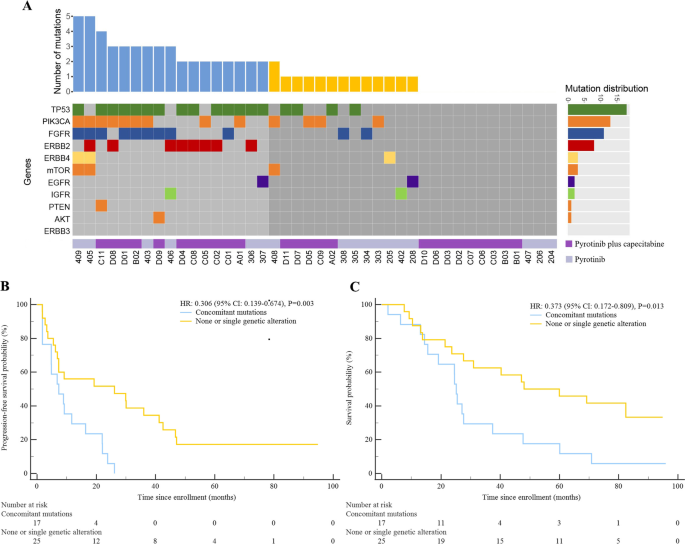
实验目的是探索与吡咯替尼疗效相关的生物标志物。方法为对42例患者基线外周血循环肿瘤DNA(ctDNA)进行1021基因靶向测序,分析HER2相关信号网络(HER2旁路、PI3K/Akt/mTOR、TP53)的突变,并关联生存结局。结果显示:常见突变基因为TP53(42.9%)、PIK3CA(31.0%)、FGFR(26.2%);与无突变或单一突变患者相比,多通路共突变患者(HER2旁路+PI3K/Akt/mTOR+TP53中的多个通路突变)中位PFS更短(7.3个月 vs 26.1个月,P=0.003)、中位OS更短(25.1个月 vs 48.0个月,P=0.013);此外,ERBB2突变患者中位PFS仅4.8个月(vs 野生型16.4个月,P=0.010),PIK3CA突变患者中位PFS 8.9个月(vs 野生型22.1个月,P=0.013)(图3为突变分布与生存关联)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用基于下一代测序(NGS)的ctDNA靶向测序试剂盒、SPSS/R软件进行生存分析。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为HER2相关信号网络的多通路共突变(包括HER2旁路信号通路、PI3K/Akt/mTOR通路、TP53的共突变)。筛选逻辑为“ctDNA测序分析基线突变→关联生存结局筛选潜在标志物”;验证逻辑为通过42例患者的生存数据,确认共突变与更差生存的相关性。
研究过程详述
Biomarker来源为42例患者的基线外周血ctDNA;验证方法为1021基因靶向测序,检测HER2相关通路的基因突变;生存关联数据显示:多通路共突变患者中位PFS 7.3个月(vs 无/单一突变26.1个月,P=0.003),中位OS 25.1个月(vs 48.0个月,P=0.013),样本量n=42。
核心成果提炼
该Biomarker的功能关联:多通路共突变是吡咯替尼方案的预后标志物——存在共突变的患者生存显著更差;创新性:首次在吡咯替尼研究中发现多通路共突变与长期生存的关联,弥补了单一标志物难以捕捉肿瘤异质性的不足。此外,ERBB2突变(中位PFS 4.8个月 vs 16.4个月,P=0.010)、PIK3CA突变(8.9个月 vs 22.1个月,P=0.013)也与更短PFS相关,为探索吡咯替尼耐药机制提供了方向。
本研究通过汇总Ⅰ期研究的长期数据,明确了吡咯替尼方案的生存获益,并发现多通路共突变可作为预后生物标志物,为HER2阳性转移性乳腺癌的精准治疗提供了重要证据。
