1. 领域背景与文献引入
文献英文标题:The predictive value of tumor mutation burden for immune checkpoint inhibitors therapy in non-small cell lung cancer is affected by patients’ age;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌免疫治疗生物标志物。
非小细胞肺癌(NSCLC)是全球肺癌的主要亚型,占比约85%,其晚期患者的传统治疗疗效有限。免疫检查点抑制剂(ICIs)如PD-1/PD-L1抗体的问世,通过解除肿瘤对T细胞的免疫抑制,显著改善了晚期NSCLC患者的预后,成为当前的核心治疗手段之一。然而,ICIs的疗效存在显著个体差异,仅约20%-30%的患者能获得长期 benefit,因此亟需可靠的生物标志物筛选优势人群。
肿瘤突变负荷(TMB)作为反映肿瘤免疫原性的关键指标,通过衡量肿瘤基因组中体细胞突变的数量,间接反映肿瘤产生新生抗原的能力——高TMB通常与更多的新生抗原表达相关,能更有效地激活T细胞免疫反应,因此被广泛证实可预测ICIs在NSCLC、黑色素瘤等肿瘤中的疗效[1-3]。但ICIs的疗效不仅取决于肿瘤的免疫原性,还与宿主的免疫状态密切相关。年龄作为评估宿主免疫反应的重要因素,其引发的免疫衰老(immunosenescence)会导致免疫细胞数量减少、功能下降,可能影响免疫治疗的效果[4]。目前,关于年龄是否会影响TMB对NSCLC患者ICIs疗效的预测价值,尚无明确研究报道,这一空白限制了TMB在临床中的精准应用。因此,本研究针对这一核心问题展开探索,旨在明确年龄对TMB预测体系的影响,为NSCLC患者的免疫治疗分层提供更精准的依据。
2. 文献综述解析
作者在文献综述中系统梳理了两方面的现有研究:其一,TMB作为ICIs疗效预测标志物的研究进展——指出TMB通过增加肿瘤免疫原性,在NSCLC等肿瘤中有效预测ICIs响应,是当前最受关注的生物标志物之一[1-3];其二,免疫衰老对免疫治疗的影响——强调年龄相关的免疫功能下降会降低肿瘤细胞的清除效率,增加老年患者的癌症发病率,但其对ICIs疗效的具体影响尚未明确[4]。
现有研究的关键结论包括:TMB是ICIs疗效的有效预测因子,免疫衰老会影响免疫治疗效果;但局限性在于未将年龄因素整合到TMB的预测体系中,忽略了宿主免疫状态对TMB预测价值的调节作用。本研究的创新之处在于首次探索了年龄对TMB预测NSCLC患者ICIs疗效的影响,通过整合多队列临床数据,填补了“年龄是否调节TMB预测价值”这一研究空白,为TMB的临床应用提供了更全面的视角。
3. 研究思路总结与详细解析
本研究的整体框架为:基于“年龄影响宿主免疫状态,进而调节TMB对ICIs的预测价值”的假设,通过系统检索已发表的NSCLC免疫治疗临床队列数据,分析不同年龄组中TMB与 durable clinical benefit(DCB,指持续6个月以上的临床 benefit)、无进展生存期(PFS)、总生存期(OS)的关联,验证年龄对TMB预测价值的影响。研究路线遵循“假设提出→数据获取→分层分析→结果验证”的闭环逻辑。
3.1 临床数据获取与队列选择
实验目的:获取符合条件的NSCLC免疫治疗临床队列,为后续分层分析提供数据基础。
方法细节:通过系统文献检索,纳入三个已发表的NSCLC免疫治疗队列(Samstein等2019、Rizvi等2018、Hellmann等2018),共包含665例接受ICIs治疗的NSCLC患者;数据来源于cBioPortal(Samstein队列、Rizvi队列)和ScienceDirect(Hellmann队列)。
结果解读:成功纳入三个符合条件的队列,患者的临床特征(如年龄、性别、治疗方案、TMB水平等)总结于附加文件2表S1,为后续年龄分层分析提供了可靠的人群基础。
产品关联:文献未提及具体实验产品,领域常规使用下一代测序(NGS)检测肿瘤组织的突变负荷,使用cBioPortal等数据库获取公开的临床数据。
3.2 TMB与 durable clinical benefit(DCB)的关联分析
实验目的:分析不同年龄组中TMB对ICIs治疗后DCB的预测价值。
方法细节:将患者按年龄分为agelow组(年轻患者)和agehigh组(老年患者,分组阈值由队列中位数年龄确定),采用受试者工作特征(ROC)曲线分析高TMB(高于队列中位数)对DCB的预测能力。
结果解读:如图1所示(
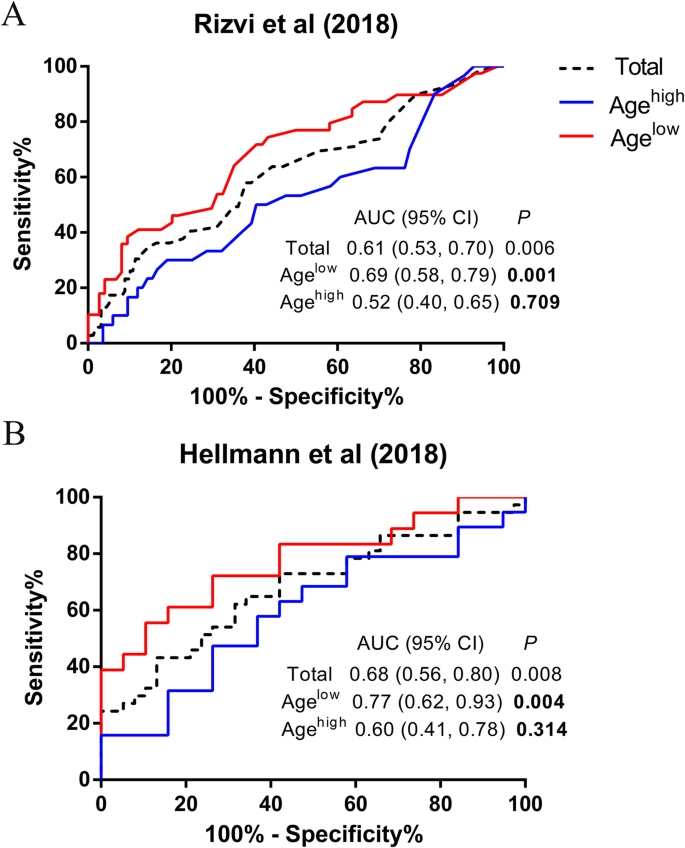
),agelow组中高TMB可显著预测更好的DCB(ROC曲线关联显著),而agehigh组中TMB与DCB无显著关联。这一结果初步验证了年龄对TMB预测DCB的调节作用——年轻患者中TMB的预测价值更显著。
产品关联:文献未提及具体实验产品,领域常规使用R语言的pROC包或SPSS软件进行ROC曲线分析。
3.3 TMB与无进展生存期(PFS)的关联分析
实验目的:进一步验证不同年龄组中TMB与PFS的关联,明确年龄对TMB预测价值的影响。
方法细节:使用Kaplan-Meier曲线分析高TMB与低TMB患者的PFS差异(以疾病进展或死亡为终点),通过Cox比例风险模型计算风险比(HR)及95%置信区间(CI)(HR<1表示高TMB患者生存期更长),并采用meta分析合并多队列结果以增强结论可靠性。
结果解读:如图2所示(
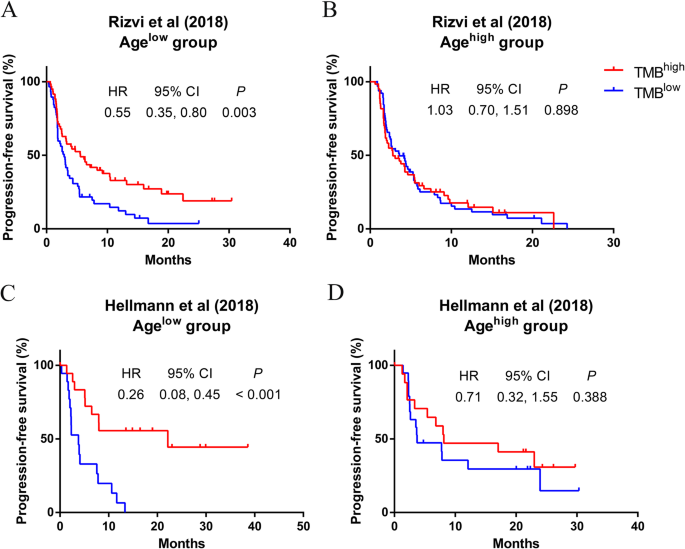
),agelow组中高TMB患者的PFS显著延长:Rizvi队列中高TMB患者的HR为0.55(95%CI 0.35-0.80,n=队列样本量,P=0.003),Hellmann队列中HR为0.26(95%CI 0.08-0.45,n=队列样本量,P<0.001);多变量调整(校正年龄、性别、分期等因素)后,这一关联仍显著(Rizvi队列调整后HR=0.54,P=0.004;Hellmann队列调整后HR=0.23,P=0.001)。而agehigh组中TMB与PFS无显著关联:Rizvi队列HR为1.03(95%CI 0.70-1.51,P=0.898),Hellmann队列HR为0.71(95%CI 0.32-1.55,P=0.388)。meta分析结果(图3,
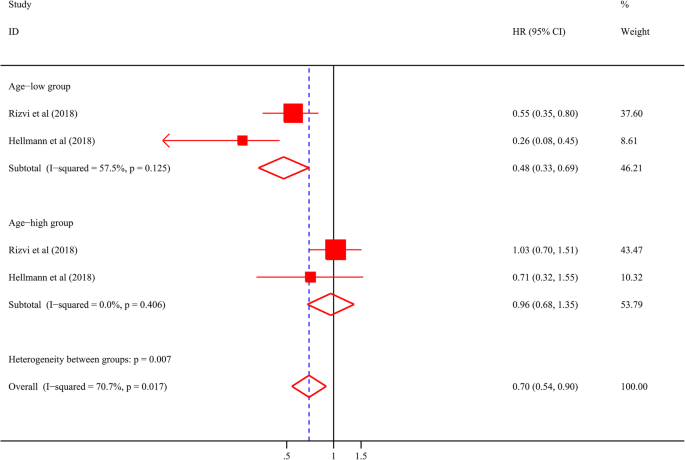
)显示,agelow组与agehigh组的异质性显著(P=0.007),进一步验证了年龄对TMB预测PFS的调节作用。
产品关联:文献未提及具体实验产品,领域常规使用R语言的survival包进行Kaplan-Meier分析和Cox回归,使用meta包或RevMan软件进行meta分析。
3.4 TMB与总生存期(OS)的关联分析
实验目的:分析不同年龄组中TMB与OS的关联,探索不同TMB cutoff值对结果的影响。
方法细节:分别采用中位数TMB(队列中TMB的中间值)和最高四分位数TMB(队列中TMB最高的25%)作为cutoff值,使用Kaplan-Meier曲线和Cox回归分析TMB与OS的关系(以死亡为终点)。
结果解读:当以中位数TMB为cutoff时,agelow组(HR=0.72,95%CI 0.46-1.07,P=0.112)和agehigh组(HR=1.03,95%CI 0.72-1.47,P=0.881)中TMB与OS均无显著关联,但agelow组呈现出高TMB患者OS更长的趋势;当以最高四分位数TMB为cutoff时,agelow组中高TMB患者的OS显著延长(HR=0.43,95%CI 0.30-0.76,n=队列样本量,P=0.007),而agehigh组仍无显著关联(HR=0.80,95%CI 0.53-1.19,P=0.282)。多变量分析结果与上述一致,验证了cutoff值对TMB预测OS的影响,同时再次支持年龄的调节作用——仅在年轻患者中,高TMB能显著预测更长的OS。
产品关联:文献未提及具体实验产品,领域常规使用生存分析方法进行OS评估。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的Biomarker为肿瘤突变负荷(TMB),属于肿瘤基因组生物标志物(反映肿瘤基因组的突变特征)。其筛选/验证逻辑为:基于已发表的NSCLC免疫治疗队列数据,通过年龄分层分析验证TMB对ICIs疗效的预测价值,明确年龄对该预测体系的调节作用。
研究过程详述
Biomarker的来源为已发表的NSCLC免疫治疗临床队列数据(包括Samstein、Rizvi、Hellmann三个队列,共665例患者),数据来源于cBioPortal和ScienceDirect数据库;验证方法包括:1)ROC曲线分析TMB与 durable clinical benefit(DCB)的关联;2)Kaplan-Meier曲线和Cox回归分析TMB与无进展生存期(PFS)、总生存期(OS)的关联;3)meta分析合并多队列结果以增强结论可靠性。
特异性与敏感性数据方面:agelow组中TMB预测DCB的ROC曲线显示较好的准确性(文献未明确给出具体AUC值,但指出关联显著);预测PFS的风险比(HR)在agelow组显著低于agehigh组(如Rizvi队列HR=0.55 vs 1.03,Hellmann队列HR=0.26 vs 0.71),提示TMB在年轻患者中具有更好的预测敏感性——即高TMB更能准确识别出能从ICIs中获益的年轻患者。
核心成果提炼
本研究的核心成果为“TMB对NSCLC患者ICIs治疗的预测价值受年龄调节,年轻患者(agelow组)中TMB的预测价值显著优于老年患者(agehigh组)”。具体表现为:
1. durable clinical benefit(DCB):agelow组中高TMB可显著预测更好的DCB,而agehigh组无显著关联;
2. 无进展生存期(PFS):agelow组中高TMB患者的PFS显著延长(Rizvi队列HR=0.55,95%CI 0.35-0.80,P=0.003;Hellmann队列HR=0.26,95%CI 0.08-0.45,P<0.001),多变量分析仍显著;
3. 总生存期(OS):当以最高四分位数TMB为cutoff时,agelow组中高TMB患者的OS显著延长(HR=0.43,95%CI 0.30-0.76,P=0.007),而agehigh组无显著关联。
本研究的创新性在于首次明确了年龄对TMB预测ICIs疗效的调节作用,纠正了“TMB对所有患者具有一致预测价值”的传统认知,为TMB的临床应用提供了重要补充——临床医生在使用TMB预测NSCLC患者的ICIs疗效时,需考虑患者的年龄因素,年轻患者可能更受益于TMB指导的治疗决策,而老年患者可能需要结合其他生物标志物(如PD-L1表达、肿瘤微环境特征)进行分层。
参考文献
[1] Samstein RM, et al. Tumor mutational load predicts survival after immunotherapy across multiple cancer types. Nat Genet. 2019;51(2):202–6.
[2] Wu Y, et al. The predictive value of tumor mutation burden on efficacy of immune checkpoint inhibitors in cancers: a systematic review and meta-analysis. Front Oncol. 2019;9:1161.
[3] McGranahan N, et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science. 2016;351(6280):1463–9.
[4] Elias R, et al. Aging, immune senescence, and immunotherapy: a comprehensive review. Semin Oncol. 2018;45(4):187–200.
(注:参考文献为文献原文引用,完整列表见原文。)
