1. 领域背景与文献引入
文献英文标题:LRG1, a novel serum biomarker for iMCD disease activity;发表期刊:Biomark Res;影响因子:未公开;研究领域:特发性多中心Castleman病(iMCD)生物标志物研究。
特发性多中心Castleman病(iMCD)是一种罕见的淋巴增殖性疾病,以细胞因子风暴介导的全身炎症反应和多器官功能障碍为核心特征,临床异质性极强——不同亚型(如iMCD-TAFRO、iMCD-IPL)的症状、预后差异显著。当前iMCD治疗反应评估主要依赖临床症状、生化标志物(如C反应蛋白,CRP)及淋巴结大小,但因疾病异质性大,这些指标的敏感性不足:部分患者经IL-6靶向治疗(如siltuximab)后,CRP虽下降但疾病仍持续活动,提示需寻找更精准的生物标志物。在此背景下,本研究聚焦血清蛋白质组学,旨在筛选能更敏感反映iMCD疾病活动及治疗反应的新型生物标志物。
2. 文献综述解析
作者通过系统评述现有研究,明确iMCD生物标志物的核心需求:其一,现有治疗反应评估方法(症状+CRP+淋巴结大小)因疾病异质性导致敏感性不足;其二,IL-6是iMCD细胞因子风暴的关键驱动因子,但靶向IL-6治疗并非对所有患者有效,而CRP作为IL-6主要诱导的急性时相蛋白,在非响应者中无法准确反映疾病活动;其三,LRG1(亮氨酸-rich α2-糖蛋白1)作为一种响应更广泛细胞因子(IL-6、TNFα、IL-1β等)的急性时相蛋白,已在类风湿关节炎、COVID-19等炎症疾病中被证实为更可靠的炎症标志物,可能弥补CRP的局限性。
基于此,作者的创新点在于:首次将蛋白质组学与大样本验证结合,系统评估LRG1在iMCD中的生物标志物价值——不仅验证其与治疗反应的关联,还探讨其在不同亚型中的差异,为iMCD的精准监测提供新候选。
3. 研究思路总结与详细解析
整体框架
研究目标:筛选iMCD疾病活动及治疗反应相关的血清生物标志物;核心科学问题:寻找比CRP更敏感的iMCD治疗反应标志物,尤其是IL-6靶向治疗中的疾病活动监测;技术路线:血清蛋白质组学筛选→大样本ELISA验证→siltuximab治疗连续监测→iMCD亚型炎症特征分析。
3.1 血清蛋白质组学筛选差异蛋白
实验目的:从iMCD患者血清中筛选与疾病活动相关的差异表达蛋白。
方法细节:收集17例iMCD患者的33份血清样本(16例发作期、4例生化部分缓解、13例生化完全缓解),采用数据非依赖采集(DIA)质谱技术进行蛋白质组学分析,定量检测血清蛋白表达水平。
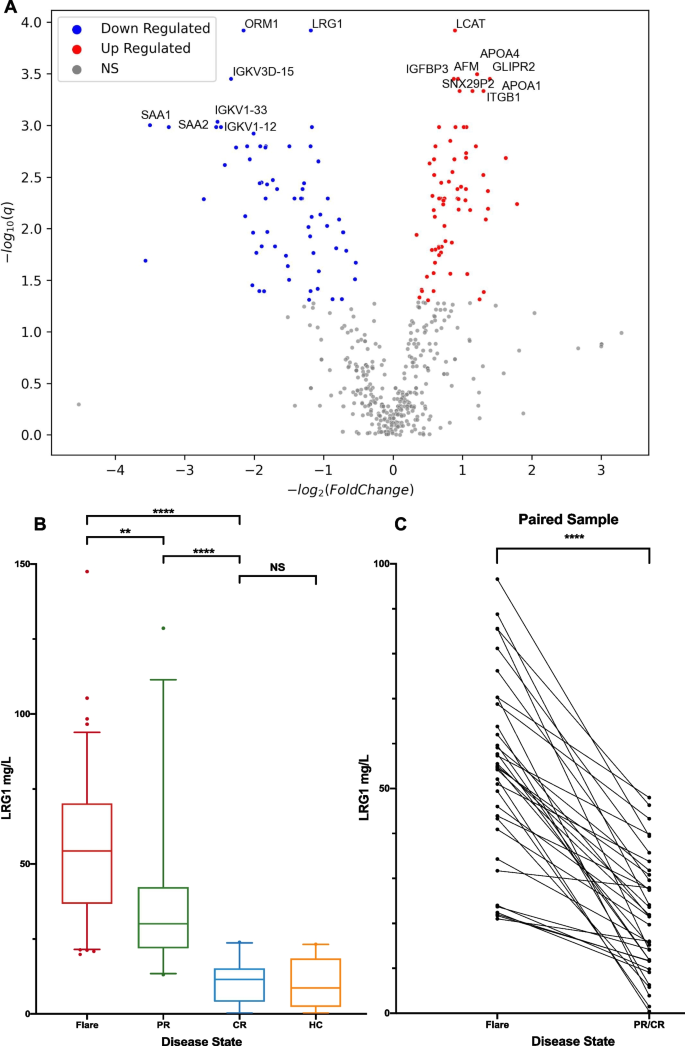
结果解读:共检测到517个可定量蛋白,其中130个在发作期与完全缓解期存在显著差异表达(图1A)。LRG1是差异最显著的蛋白之一——发作期水平显著高于完全缓解期。
实验所用关键产品:文献未提及具体实验产品,领域常规使用DIA质谱系统(如Thermo Fisher Orbitrap系列)及血清蛋白提取试剂盒。
3.2 大样本ELISA验证LRG1与治疗反应的关联
实验目的:验证蛋白质组学筛选的LRG1在更大样本中的表达差异及与治疗反应的关联。
方法细节:纳入100例iMCD患者的146份血清样本(96例发作期、28例生化部分缓解、22例生化完全缓解)及22例健康对照,采用酶联免疫吸附试验(ELISA)定量检测血清LRG1水平。
结果解读:血清LRG1水平随治疗响应呈阶梯式下降——发作期为54.5±24.2 mg/L,部分缓解期为36.2±23.6 mg/L,完全缓解期为10.6±7.2 mg/L,三组间差异均有统计学意义(发作期vs部分缓解期,p=0.0023;发作期vs完全缓解期,p<0.0001;部分缓解期vs完全缓解期,p<0.0001);完全缓解期LRG1水平与健康对照(9.8±8.4 mg/L)无显著差异(p=0.9997)(图1B)。35例患者的配对样本分析显示,发作期到缓解期LRG1平均下降32.3±18.6 mg/L(p<0.0001)(图1C)。

实验所用关键产品:文献未提及具体ELISA试剂盒,领域常规使用针对LRG1的特异性ELISA试剂盒(如R&D Systems的Human LRG1 Quantikine ELISA Kit)。
3.3 siltuximab治疗患者的LRG1连续监测
实验目的:评估LRG1在IL-6靶向治疗中的疾病活动监测价值。
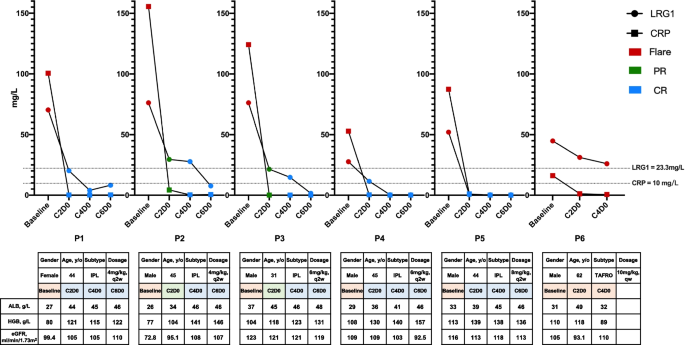
方法细节:对6例接受siltuximab(抗IL-6单抗)治疗的iMCD患者,连续检测血清LRG1、CRP及其他生化标志物(白蛋白、血红蛋白、估算肾小球滤过率)。
结果解读:LRG1水平随疾病活动逐渐下降,与白蛋白、血红蛋白等治疗反应标志物的变化趋势一致;而CRP在治疗后骤降,无法反映持续的炎症活动——1例非响应患者中,CRP被抑制但LRG1仍升高,提示LRG1更能准确反映疾病活动(图2)。
实验所用关键产品:文献未提及具体试剂,领域常规使用siltuximab及生化检测试剂盒。
3.4 iMCD亚型的LRG1及炎症标志物分析
实验目的:探讨LRG1在iMCD不同亚型中的差异及炎症通路关联。
方法细节:纳入发作期iMCD患者76例(26例iMCD-TAFRO、37例iMCD-IPL、33例iMCD-NOS),检测血清LRG1、CRP、IL-6水平及CRP/LRG1比值。
结果解读:iMCD-IPL患者的LRG1、CRP、IL-6水平显著高于iMCD-TAFRO和iMCD-NOS,且CRP/LRG1比值最高(p<0.05)。这提示iMCD-IPL的炎症更依赖IL-6通路,而其他亚型可能涉及更多非IL-6驱动的炎症因子(如TNFα、IL-1β)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究聚焦的生物标志物为血清LRG1,筛选逻辑形成完整闭环:
1. 基于17例iMCD患者的33份血清样本,通过DIA蛋白质组学筛选出差异最显著的LRG1;
2. 大样本ELISA验证(146份患者样本+22份健康对照)证实其与治疗反应的关联;
3. 连续监测siltuximab治疗患者,验证其在IL-6靶向治疗中的疾病活动监测价值;
4. 分析不同亚型的LRG1差异,关联炎症通路特征。
研究过程与数据
LRG1的来源为iMCD患者及健康对照的血清样本;验证方法为ELISA定量检测;敏感性与特异性数据如下:
- 敏感性:发作期LRG1水平(54.5±24.2 mg/L)显著高于完全缓解期(10.6±7.2 mg/L,p<0.0001),配对样本中发作期到缓解期的下降幅度达32.3±18.6 mg/L(p<0.0001);
- 特异性:完全缓解期LRG1水平与健康对照无差异(p=0.9997);
- 亚型差异:iMCD-IPL的LRG1水平显著高于其他亚型(p<0.05)。
核心成果与创新性
本研究的核心成果为:血清LRG1是iMCD疾病活动及治疗反应的新型生物标志物,其创新性体现在三方面:
1. 更敏感的治疗反应监测:LRG1随疾病活动逐渐变化,与白蛋白、血红蛋白等临床指标一致,而CRP在siltuximab治疗后骤降,无法反映持续炎症(如非响应患者的LRG1仍升高);
2. 亚型特异性:LRG1能区分iMCD不同亚型的炎症通路差异(iMCD-IPL更依赖IL-6),为亚型精准治疗提供依据;
3. 填补CRP的局限性:LRG1响应更广泛的细胞因子(IL-6、TNFα、IL-1β等),适合IL-6靶向治疗中的疾病监测——这是CRP(仅依赖IL-6)无法实现的。
统计学与临床价值
关键统计学结果:
- 发作期与完全缓解期LRG1差异显著(p<0.0001);
- 配对样本中治疗前后LRG1下降显著(p<0.0001);
- iMCD-IPL与其他亚型的LRG1差异显著(p<0.05)。
临床价值:LRG1有望作为iMCD生物标志物panel的重要补充,尤其适用于IL-6靶向治疗的患者监测及亚型精准分层,为iMCD的个性化治疗提供依据。
综上,本研究通过多维度验证,明确LRG1是iMCD疾病活动及治疗反应的新型血清生物标志物,为iMCD的精准监测与机制研究提供了关键线索。未来需在更大样本中验证其参考范围,推动临床转化。
