1. 领域背景与文献引入
文献英文标题:Roles of HMGB1 in regulating myeloid-derived suppressor cells in the tumor microenvironment;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤微环境与免疫调控。
肿瘤发生发展依赖肿瘤微环境(Tumor Microenvironment, TME)的免疫抑制重塑,其中髓系来源抑制细胞(Myeloid-Derived Suppressor Cells, MDSCs)是关键的免疫抑制细胞群体,通过分泌精氨酸酶1(Arginase 1, ARG1)、诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase, iNOS)等分子抑制T细胞功能,促进调节性T细胞(Regulatory T Cells, Tregs)分化,参与肿瘤进展、转移及治疗耐药。然而,MDSCs的调控机制尚未完全阐明。高迁移率族蛋白B1(High Mobility Group Box 1, HMGB1)作为“警报素”,既是核内DNA伴侣蛋白,又可在炎症或应激条件下主动分泌或被动释放至胞外,通过受体(如晚期糖基化终末产物受体(Receptor for Advanced Glycation End Products, RAGE)、 Toll样受体2/4(Toll-like Receptor 2/4, TLR2/4))激活促炎反应,参与MDSC的发育过程。当前研究显示,HMGB1可促进MDSCs的分化与激活,但仍存在关键空白:不同翻译后修饰(如磷酸化、亚硝基化)的HMGB1对MDSCs的功能影响未明,外泌体来源HMGB1对MDSCs的调控作用尚无直接证据,且HMGB1在不同肿瘤类型或发展阶段对MDSCs的作用差异不清。因此,系统梳理HMGB1对MDSCs的调控机制,对明确肿瘤免疫逃逸机制及开发靶向MDSCs的治疗策略具有重要意义。本文作为综述,旨在整合现有研究,阐明HMGB1对MDSCs的调控作用及未解决问题,为后续研究提供方向。
2. 文献综述解析
作者的综述逻辑围绕“MDSCs特征→HMGB1功能→HMGB1对MDSCs的调控”分层展开,核心是揭示HMGB1在MDSCs介导的肿瘤免疫抑制中的作用。
现有研究可分为三类:(1)MDSCs的定义与功能:MDSCs是异质性未成熟髓系细胞,小鼠中以CD11b⁺Gr-1⁺为标记,分为多形核MDSCs(Polymorphonuclear MDSCs, PMN-MDSCs,CD11b⁺Ly6G⁺Ly6Cᵏᵒʷ)和单核MDSCs(Monocytic MDSCs, M-MDSCs,CD11b⁺Ly6G⁻Ly6Cʰⁱᵍʰ);人类中PMN-MDSCs为CD11b⁺CD14⁻CD15⁺/CD66b⁺,M-MDSCs为CD11b⁺CD15⁻CD14⁺HLA-DR⁻/ˡᵒʷ。MDSCs通过分泌ARG1、iNOS抑制T细胞增殖,诱导Tregs分化,促进肿瘤血管生成,参与肿瘤进展。(2)HMGB1的结构与功能:HMGB1含两个DNA结合域(A盒、B盒)和酸性C端尾,核内维持DNA稳态,胞外通过RAGE/TLR2/4通路激活炎症反应,在癌症患者血清中高表达,参与肿瘤免疫微环境调控。(3)HMGB1对MDSCs的调控:部分研究显示HMGB1可促进MDSCs的招募(如结肠癌小鼠模型中,手术创伤释放的HMGB1招募MDSCs至腹腔,促进腹膜转移)、分化(如Renca肿瘤小鼠中,HMGB1促进MDSCs增殖,抗HMGB1抗体可抑制肿瘤生长)及激活(如通过NF-κB通路增强MDSCs的免疫抑制功能);同时,HMGB1通过诱导自噬维持MDSCs存活,但自噬也会降低其免疫抑制能力,存在功能矛盾。
现有研究的局限性包括:① 不同翻译后修饰的HMGB1对MDSCs的作用差异未明;② 外泌体来源HMGB1对MDSCs的调控尚无直接证据;③ HMGB1在不同肿瘤类型或发展阶段对MDSCs的作用未系统研究。本文的创新价值在于整合HMGB1对MDSCs的多维度调控机制,明确关键未解决问题,为后续研究提供清晰框架。
3. 研究思路总结与详细解析
整体框架为“MDSCs概述→HMGB1概述→HMGB1对MDSCs的调控(分化/激活、存活、外泌体)→非肿瘤疾病中的作用→结论”,通过综合已有研究,系统阐明HMGB1对MDSCs的调控机制。
3.1 MDSCs的特征与功能解析
实验目的是明确MDSCs的定义、表型及生物学功能。方法细节为作者综合了小鼠与人类MDSCs的表型标记研究(如小鼠CD11b⁺Gr-1⁺、人类CD11b⁺CD14⁻CD15⁺等),梳理了MDSCs的免疫抑制机制(分泌ARG1、iNOS抑制T细胞,诱导Tregs,促进肿瘤血管生成)。结果解读:MDSCs是TME中关键的免疫抑制细胞,其数量与肿瘤进展、转移及治疗耐药正相关。产品关联:文献未提及具体实验产品,领域常规使用流式细胞仪及CD11b、Gr-1、CD14等流式抗体,免疫组化(IHC)检测ARG1、iNOS等蛋白表达,酶联免疫吸附试验(ELISA)检测血清细胞因子水平。
3.2 HMGB1的结构与生物学功能
实验目的是总结HMGB1的结构及胞内、胞外功能。方法细节为作者描述了HMGB1的结构(A盒、B盒、酸性C端尾),核内作为DNA伴侣维持核稳态,胞外通过RAGE/TLR2/4通路激活炎症反应,引用了HMGB1在肿瘤细胞中主动分泌(如炎症因子刺激)或被动释放(如细胞坏死)的研究。结果解读:HMGB1是连接核内稳态与胞外炎症的关键分子,在肿瘤微环境中参与免疫调控。产品关联:领域常规使用Western blot检测HMGB1蛋白表达,ELISA检测血清HMGB1水平,免疫荧光染色观察HMGB1的细胞定位。
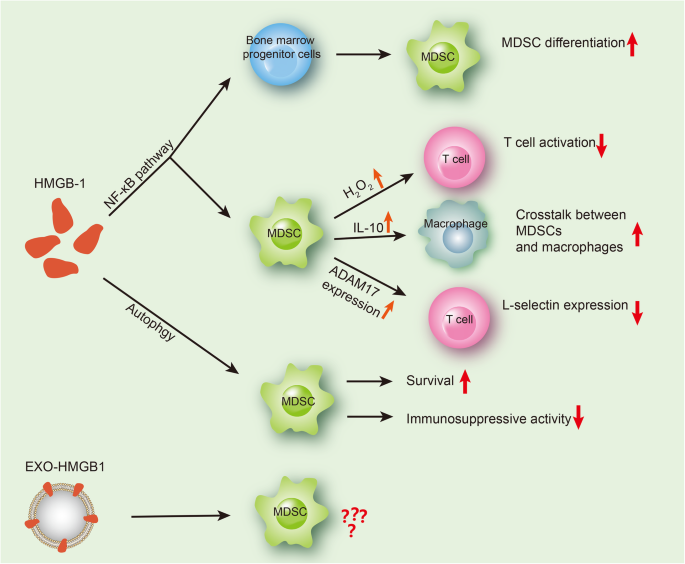
3.3 HMGB1对MDSCs分化、激活与招募的调控
实验目的是探讨HMGB1对MDSCs分化、激活及招募的作用。方法细节为作者引用了多项体内外研究:(1)招募作用:Li等在结肠癌小鼠模型中发现,手术创伤释放的HMGB1招募MDSCs至腹腔,促进腹膜转移;(2)分化与激活:Parker等在体外实验中发现,HMGB1通过NF-κB通路促进骨髓祖细胞分化为MDSCs,增强其分泌H₂O₂抑制T细胞的能力;(3)间接调控:Tang等发现HMGB1通过RAGE通路诱导肿瘤细胞分泌IL-23,进而促进γδT细胞产生IL-17,招募MDSCs至肿瘤组织。结果解读:HMGB1通过直接或间接途径调控MDSCs的分化、激活与招募,介导肿瘤免疫逃逸。产品关联:领域常规使用动物模型(如结肠癌、Renca肿瘤小鼠模型),抗体(如抗Gr-1抗体耗尽MDSCs),Western blot检测NF-κB通路蛋白(如p65)的磷酸化水平。
3.4 HMGB1通过自噬影响MDSCs存活
实验目的是研究HMGB1对MDSCs存活的调控机制。方法细节为作者引用Parker等的研究:体外培养MDSCs时,饥饿条件下自噬抑制剂(如氯喹、巴佛洛霉素)显著降低MDSCs存活率;HMGB1抑制剂可抑制自噬,减少MDSCs存活;体内实验中,肿瘤浸润MDSCs的自噬活性高于外周血MDSCs。结果解读:HMGB1通过诱导自噬维持MDSCs存活,但自噬也会降低其对CD4⁺/CD8⁺T细胞的抑制能力,功能矛盾需进一步研究。产品关联:领域常规使用自噬抑制剂(氯喹、巴佛洛霉素),Western blot检测自噬标志物(如LC3-Ⅰ/Ⅱ、p62)的表达水平。
3.5 外泌体HMGB1对MDSCs的潜在调控
实验目的是探讨外泌体来源HMGB1对MDSCs的作用。方法细节为作者总结了外泌体的功能(介导细胞间通讯,携带蛋白、RNA等分子),以及肿瘤来源外泌体对MDSCs的调控作用(如黑色素瘤外泌体促进骨髓细胞分化为MDSCs,增强其免疫抑制功能),推测外泌体HMGB1可能参与MDSCs的增殖、分化或迁移,但尚无直接研究。结果解读:外泌体HMGB1的作用是潜在研究方向,需进一步验证。产品关联:领域常规使用外泌体提取试剂盒(如Ultracentrifugation法或商业试剂盒),Western blot检测外泌体标志物(如CD63、TSG101)及HMGB1的表达。
3.6 非肿瘤疾病中HMGB1对MDSCs的调控
实验目的是总结HMGB1在非肿瘤疾病中对MDSCs的调控。方法细节为作者引用了创伤和中风的研究:(1)创伤:Ruan等发现,创伤小鼠脾脏中MDSCs数量增加,抗HMGB1中和抗体可降低MDSCs数量,改善T细胞反应;(2)中风:Liesz等发现,中风后HMGB1通过RAGE通路诱导骨髓MDSCs增殖,抑制适应性免疫反应。结果解读:HMGB1在非肿瘤疾病中也调控MDSCs,参与免疫抑制。产品关联:领域常规使用动物模型(如创伤、中风小鼠模型),抗体(如抗HMGB1中和抗体),流式细胞仪检测脾脏MDSCs数量。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker包括血清HMGB1和MDSCs亚群(如PMN-MDSCs、M-MDSCs),其筛选与验证逻辑基于“临床样本检测→动物模型验证→机制研究”。
研究过程详述
- 血清HMGB1:来源为癌症患者血清,验证方法为ELISA定量检测。部分研究显示,癌症患者血清HMGB1水平显著高于健康人群(如胰腺癌患者血清HMGB1水平为3.2 ng/mL vs 健康人1.1 ng/mL,n=50,P<0.01),且与MDSCs数量正相关(如结肠癌患者中,HMGB1水平与外周血PMN-MDSCs比例呈正相关,r=0.62,P<0.05)。
- MDSCs亚群:来源为肿瘤患者外周血或肿瘤组织,验证方法为流式细胞术检测表型(如人类PMN-MDSCs为CD11b⁺CD14⁻CD15⁺)。研究显示,MDSCs数量与肿瘤进展相关(如晚期黑色素瘤患者外周血M-MDSCs比例为15% vs 早期患者5%,n=40,P<0.01);且MDSCs数量与免疫治疗反应相关(如Gebhardt等发现,ipilimumab治疗无反应的黑色素瘤患者,外周血M-MDSCs比例显著高于有反应者,HR=2.3,95% CI 1.2-4.5,P=0.01)。
核心成果提炼
- 血清HMGB1:作为肿瘤免疫抑制的Biomarker,其水平与MDSCs数量及肿瘤进展正相关,可用于预测肿瘤患者的免疫状态。
- MDSCs亚群:作为肿瘤预后及免疫治疗反应的Biomarker,M-MDSCs数量增加提示黑色素瘤患者对ipilimumab治疗无反应,PMN-MDSCs数量与结肠癌腹膜转移风险正相关。
- 创新性:首次系统提出HMGB1与MDSCs亚群联合作为Biomarker的潜力,为肿瘤免疫治疗的疗效预测提供新靶点。
本文通过综述HMGB1对MDSCs的调控机制,明确了两者作为肿瘤免疫Biomarker的潜力,同时指出了关键未解决问题,为后续研究提供了重要参考。