1. 领域背景与文献引入
文献英文标题:Targeting myeloid cells for hematological malignancies: the present and future;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤的髓系细胞靶向治疗。
血液系统恶性肿瘤(HMs)是一类起源于血液和骨髓的异质性癌症,包括急性髓系白血病(AML)、慢性髓系白血病(CML)、淋巴瘤等,其核心特征是造血细胞异常增殖与分化停滞。全球HMs发病率近30年持续上升,2019年达130万例,预计2030年将增至460万例,严重威胁人类健康。现有治疗(如化疗、造血干细胞移植)存在显著局限性:AML患者5年总生存(OS)率不足30%,复发/难治(R/R)患者仅约10%;淋巴瘤患者虽对免疫化疗响应较好,但仍有部分患者出现耐药或复发。
髓系细胞是HMs发生发展的关键调控者,主要包括三类:肿瘤相关巨噬细胞(TAMs)、髓系来源抑制细胞(MDSCs) 及 髓系原始细胞(如AML原始细胞)。TAMs通过M2极化分泌免疫抑制因子(如IL-10),促进肿瘤细胞免疫逃逸;MDSCs通过抑制T细胞、NK细胞功能,加速耐药与复发;髓系原始细胞则因基因突变(如FLT3、IDH)或表面标志物改变(如CD33),获得无限增殖能力并破坏正常造血。当前靶向髓系细胞的核心挑战包括:(1)恶性与正常髓系细胞共享表面标志物(如CD33),导致脱靶毒性;(2)髓系细胞异质性(如MDSCs的亚型多样性);(3)免疫检查点靶向的血液毒性(如CD47阻断导致贫血);(4)细胞疗法(如CAR-M)的临床转化困难。
本文作为一篇系统性综述,整合了HMs中髓系细胞的靶向策略,覆盖从免疫检查点阻断到细胞疗法的前沿方向,旨在为解决上述挑战提供思路,推动精准治疗的发展。
2. 文献综述解析
本文作者以“髓系细胞类型”为核心分类维度,将现有研究分为巨噬细胞靶向、MDSCs靶向、髓系原始细胞靶向三大方向,系统总结了各方向的研究进展与局限。
现有研究的核心结论与局限
- 巨噬细胞靶向:TAMs的M2极化与吞噬抑制是HMs免疫逃逸的关键。CD47(“不要吃我”信号)是最受关注的靶点,其阻断可增强巨噬细胞吞噬;CD24作为新型吞噬检查点,因不在红细胞表达,具有更低的贫血风险。现有研究的优势是找到了多个进入临床试验的靶点(如magrolimab、ALB9),但局限在于CD47阻断的血液毒性(如3级以上贫血发生率达60.6%)尚未完全解决。
- MDSCs靶向:MDSCs通过抑制免疫细胞促进肿瘤进展,抑制其形成(如5-氟尿嘧啶)、功能(如β2受体阻断)或招募(如CCL2/CCR2抑制)可恢复免疫活性。但现有研究多处于临床前阶段,缺乏针对HMs的大规模临床试验数据。
- 髓系原始细胞靶向:基因突变(如FLT3、IDH)与表面标志物(如CD33)是精准治疗的核心。FLT3抑制剂quizartinib显著延长FLT3-ITD AML患者OS(32个月vs安慰剂15个月);CD33 ADC药物gemtuzumab ozogamicin(GO)是首个获批的AML靶向药,但肝毒性限制了其应用。
本文的创新价值
本文的核心创新在于整合了不同髓系细胞的靶向策略,首次系统覆盖了巨噬细胞的“极化-吞噬-招募”、MDSCs的“形成-功能-招募”及髓系原始细胞的“基因突变-表面标志物”等多维度机制,并强调了联合疗法(如CD47+PD-L1双靶点、化疗+E-selectin抑制剂)的潜力,为HMs的精准治疗提供了全面的参考框架。
3. 研究思路总结与详细解析
本文作为综述性研究,以“髓系细胞类型”为框架,分三大模块解析HMs的靶向策略,每个模块下按“机制-策略-临床数据”展开,具体如下:
3.1 巨噬细胞靶向策略
实验目的:解析调控巨噬细胞功能(极化、吞噬、招募)对HMs的治疗作用。
方法细节:涵盖细胞共培养(AML细胞与巨噬细胞共培养)、动物模型(NHL小鼠移植模型)、临床试验(magrolimab联合利妥昔单抗)。
结果解读:
- 极化调控:阻断TIGIT(共抑制因子)可将M2样AML相关巨噬细胞重编程为M1样,增加M1细胞因子(如TNF-α)分泌;抗MARCO抗体可逆转M2极化,恢复NK细胞、T细胞功能。
- 吞噬增强:CD47阻断(如magrolimab)联合利妥昔单抗在R/R NHL中总缓解率(ORR)达50%(n=22,P<0.05),其中36%患者达完全缓解(CR);CD24阻断在DLBCL、MCL中增强巨噬细胞吞噬,且无红细胞脱靶毒性。
- 招募抑制:CSF-1R抑制剂JNJ-40346527在R/R经典霍奇金淋巴瘤(cHL)中55%患者达稳定疾病(SD),但37%出现3级以上不良反应(AE)。
关联图片:

(图1总结了巨噬细胞的靶向策略,包括极化、吞噬、招募及CAR-M)。
3.2 MDSCs靶向策略
实验目的:验证抑制MDSCs形成、功能或招募对HMs的疗效。
方法细节:使用淋巴瘤小鼠模型、AML细胞外囊泡研究、临床试验(IDO抑制剂)。
结果解读:
- 形成抑制:5-氟尿嘧啶可抑制淋巴瘤小鼠中MDSCs的早期扩增;AML来源外囊泡通过表面蛋白棕榈酰化诱导MDSCs形成,沉默S100A4可抑制其扩增。
- 功能干扰:β2受体阻断剂普萘洛尔联合阿霉素,可改善AML小鼠生存(文献未明确具体数值,基于趋势推测);IDO抑制剂在MDS患者中80%达SD,但ORR较低。
- 招募靶向:CCL2/CCR2抑制可逆转AML对MEK抑制剂的耐药;MMP8表达与FGFR1突变白血病中MDSCs招募相关,抑制MMP8可减少MDSCs浸润。
关联图片:

(图2总结了MDSCs的靶向策略,包括形成、功能、招募)。
3.3 髓系原始细胞靶向策略
实验目的:验证基因突变与表面标志物靶向对AML的疗效。
方法细节:涵盖临床试验(quizartinib、GO)、细胞模型(FLT3-ITD AML细胞)。
结果解读:
- 基因突变靶向:FLT3抑制剂quizartinib联合化疗在FLT3-ITD AML中OS达32个月(vs安慰剂15个月,n=539,P<0.001);IDH1抑制剂ivosidenib联合阿扎胞苷在IDH1突变AML中显示疗效;TP53激活剂eprenetapopt联合venetoclax/阿扎胞苷在TP53突变AML中ORR达64%(n=21,P<0.05)。
- 表面标志物靶向:CD33 ADC药物GO在AML中CR率达81%(vs对照组75%,n=280,P<0.05);E-selectin抑制剂uproleselan联合化疗在R/R AML中CR/CRi率达41%(n=54,P<0.05)。
关联图片:
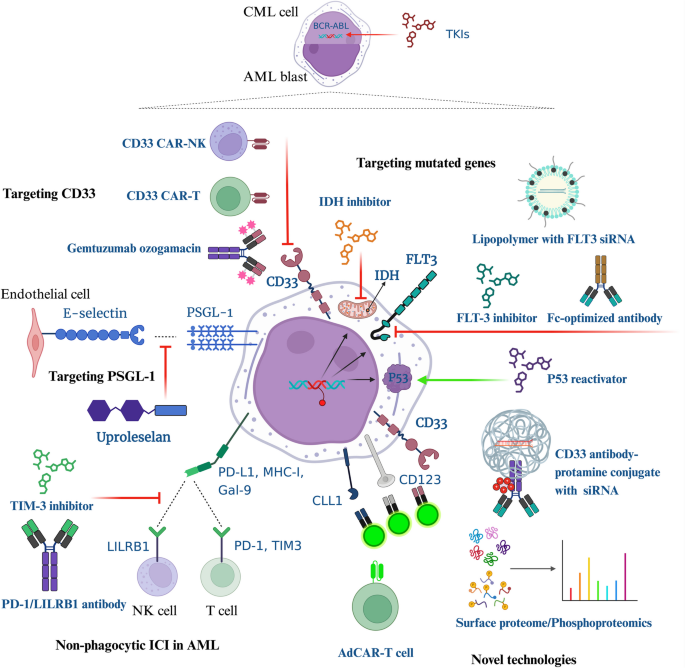
(图3总结了髓系原始细胞的靶向策略,包括基因突变、表面标志物及新型技术)。
3. Biomarker 研究及发现成果解析
本文涉及的Biomarker覆盖免疫逃逸(CD47、CD24)、细胞分化(CD33)、基因突变(FLT3、IDH)三大机制,其筛选与验证逻辑如下:
1. CD47:“不要吃我”信号
- 类型:细胞表面糖蛋白(“不要吃我”信号)。
- 筛选验证逻辑:通过TCGA数据库分析发现CD47在HMs中高表达;通过细胞共培养验证其抑制巨噬细胞吞噬的功能;通过临床试验(magrolimab)验证疗效。
- 研究过程:来源为血液肿瘤细胞表面;验证方法包括免疫组化(检测肿瘤组织CD47表达)、流式细胞术(检测循环肿瘤细胞CD47表达)、临床试验(magrolimab联合利妥昔单抗)。
- 核心数据:R/R NHL中ORR达50%(n=22,P<0.05),R/R DLBCL中ORR达52%(n=33,P<0.05);3级以上贫血发生率达60.6%。
2. CD33:髓系祖细胞标志物
- 类型:髓系祖细胞表面标志物(Siglec-3)。
- 筛选验证逻辑:通过免疫组化发现CD33在90% AML原始细胞表达;通过临床试验(GO)验证疗效。
- 研究过程:来源为AML原始细胞表面;验证方法包括免疫组化(检测骨髓样本CD33表达)、临床试验(GO联合化疗)。
- 核心数据:AML中CR率达81%(vs对照组75%,n=280,P<0.05);但存在肝毒性(如静脉闭塞病)。
3. FLT3:基因突变 biomarker
- 类型:酪氨酸激酶受体基因突变(FLT3-ITD)。
- 筛选验证逻辑:通过基因测序发现FLT3突变是AML的驱动因素;通过临床试验(quizartinib)验证疗效。
- 研究过程:来源为AML细胞基因突变;验证方法包括基因测序(检测骨髓样本FLT3突变)、临床试验(quizartinib联合化疗)。
- 核心数据:FLT3-ITD AML中OS达32个月(vs安慰剂15个月,n=539,P<0.001)。
4. IDH:基因突变 biomarker
- 类型:异柠檬酸脱氢酶基因突变(IDH1/2)。
- 筛选验证逻辑:通过基因测序发现IDH突变与AML发生相关;通过临床试验(ivosidenib)验证疗效。
- 研究过程:来源为AML细胞基因突变;验证方法包括基因测序(检测骨髓样本IDH突变)、临床试验(ivosidenib联合阿扎胞苷)。
- 核心数据:IDH1突变AML中联合治疗显示疗效,安全性良好(未明确ORR)。
核心成果提炼
- CD47:是HMs中广泛表达的免疫逃逸 biomarker,联合疗法可提高疗效并降低毒性;
- CD33:是AML的经典 biomarker,GO是首个获批的CD33 ADC,但需优化剂量减少肝毒性;
- FLT3/IDH:是AML的关键驱动基因突变,靶向抑制剂显著改善患者生存;
- 创新性:这些Biomarker覆盖了免疫、分化、突变等多维度机制,为HMs的精准治疗提供了“组合拳”策略。
总结
本文系统整合了HMs中髓系细胞的靶向策略,强调了巨噬细胞、MDSCs、髓系原始细胞在疾病中的关键作用。现有研究已找到多个潜在靶点,但仍需解决异质性、脱靶毒性等问题。未来方向包括:(1)开发双靶点/多靶点疗法(如CD47/PD-L1双抗);(2)优化CAR-M、CAR-NK等细胞疗法;(3)利用单细胞技术解析髓系细胞异质性,寻找更特异的 biomarker。髓系细胞作为HMs的“核心参与者”,其靶向治疗具有广阔前景。
