1. 领域背景与文献引入
文献英文标题:The emerging roles of N6-methyladenosine RNA methylation in human cancers;发表期刊:Biomark Res;影响因子:未公开;研究领域:RNA表观遗传学与肿瘤学。
N6-甲基腺苷(m⁶A)是真核生物中最丰富的mRNA化学修饰,占腺苷核苷酸的0.1%~0.4%,主要分布在mRNA的3"非翻译区(UTR)、终止密码子附近及长内含子中,参与调控RNA代谢的关键过程(核输出、翻译效率、降解及可变剪接)。m⁶A的动态平衡由三类调控因子维持:甲基转移酶(writer,如METTL3、METTL14、WTAP)负责催化甲基化,去甲基酶(eraser,如FTO、ALKBH5)负责去除甲基化,结合蛋白(reader,如YTHDF1-3、HNRNPA2B1)负责识别甲基化位点并介导下游功能。
近年来,m⁶A调控异常与人类疾病的关联成为研究热点,尤其是癌症——调控因子的表达失衡可通过影响 oncogene 或抑癌基因的RNA代谢,推动肿瘤发生、增殖、转移及耐药。然而,现有研究仍存在争议(如METTL3在不同癌症中的作用矛盾),且部分调控因子的功能及机制未完全阐明。在此背景下,本综述系统总结了m⁶A调控因子在各类癌症中的作用,揭示其作为肿瘤生物标志物(Biomarker)或治疗靶点的潜力,为RNA表观遗传学与肿瘤学的交叉研究提供了全景式视角。
2. 文献综述解析
作者以“m⁶A调控过程→各类癌症中的作用→临床转化潜力”为逻辑主线,对现有研究进行分类评述:
2.1 现有研究的核心结论与分类
作者将m⁶A与癌症的研究分为三大方向:
1. m⁶A调控因子的功能鉴定:明确了writer(如METTL3是催化核心)、eraser(如FTO通过去甲基化促进 oncogene 翻译)、reader(如YTHDF2通过降解抑癌基因mRNA推动肿瘤)的基本功能;
2. 癌症中的表达与机制:发现调控因子在不同癌症中存在差异表达(如METTL3在肝癌中高表达,在子宫内膜癌中低表达),且通过m⁶A依赖方式调控关键通路(如AKT、Wnt/β-catenin、EMT);
3. 临床转化潜力:部分调控因子已被证明可作为预后Biomarker(如透明细胞肾癌中ALKBH5和FTO的低表达与不良预后相关)或治疗靶点(如FTO抑制剂MA2可抑制胶质瘤生长)。
2.2 现有研究的优势与局限
- 优势:结合了高通量测序(如m⁶A-seq鉴定甲基化位点)、功能获得/缺失实验(如CRISPR-Cas9敲除METTL3)及临床样本分析(如肿瘤组织与正常组织的表达差异),实现了“机制-表型-临床”的闭环验证;
- 局限:部分调控因子的作用存在争议(如METTL3在胶质瘤中既被报道为 oncogene 也被报道为抑癌基因),且部分新型调控因子(如CBLL1、METTL16)的肿瘤相关功能尚未完全解析。
2.3 本综述的创新价值
与现有研究相比,本综述的核心贡献在于:
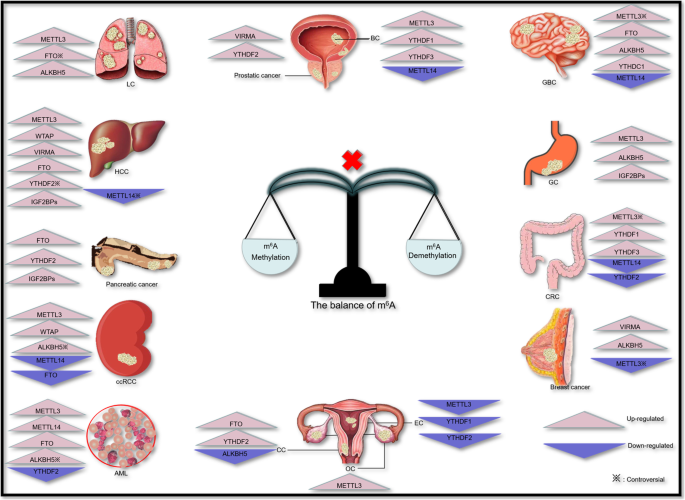
1. 系统覆盖:首次将solid瘤(胶质瘤、肺癌、肝癌等)与血液瘤(急性髓系白血病)整合,总结了m⁶A调控因子在不同癌症中的共性(如writer多为 oncogene)与差异(如reader的功能因肿瘤类型而异);
2. 临床视角:强调了调控因子作为Biomarker的潜力(如FTO在急性髓系白血病中的亚型特异性表达),并讨论了靶向m⁶A的治疗策略(如抑制剂、小干扰RNA);
3. 争议梳理:客观分析了METTL3等调控因子的矛盾结论,提出“肿瘤异质性”“细胞类型差异”是可能的原因,为后续研究提供了方向。
3. 研究思路总结与详细解析
本综述为归纳性综述,其研究思路可分为两大模块:
3.1 m⁶A调控过程的系统阐述
作者首先明确了m⁶A的分子机制,为后续癌症研究奠定基础:
- Writer:METTL3与METTL14形成1:1异二聚体,结合S-腺苷甲硫氨酸(SAM)催化甲基化;WTAP将复合物定位至核斑,VIRMA促进3"UTR及终止密码子附近的甲基化;
- Eraser:FTO优先去甲基化mRNA的5"UTR区域,促进帽非依赖翻译;ALKBH5通过去甲基化增加FOXM1等 oncogene 的RNA稳定性;
- Reader:YTHDF1结合甲基化mRNA的3"UTR,招募翻译起始因子增强翻译;YTHDF2结合后招募CCR4-NOT复合物促进mRNA降解;HNRNPA2B1参与pri-miRNA加工,IGF2BPs增强 oncogene mRNA的稳定性。
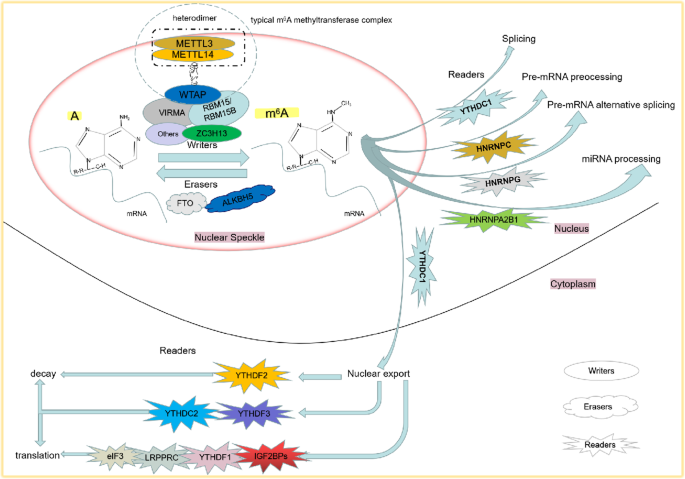
3.2 各类癌症中的m⁶A调控机制
作者按组织系统分类,详细阐述了m⁶A在10余种癌症中的作用,以下为关键案例:
- 神经系统肿瘤(胶质瘤):METTL3高表达通过m⁶A依赖方式增强SOX2的RNA稳定性,维持胶质瘤干细胞(GSCs)的自我更新;FTO和ALKBH5高表达通过去甲基化ADAM19或FOXM1,促进GSCs增殖及放疗耐药;
- 呼吸系统肿瘤(肺癌):METTL3高表达通过m⁶A修饰EGFR、TAZ等 oncogene 的mRNA,增强其翻译效率;同时,METTL3通过促进miR-143-3p的成熟,抑制VASH1表达,推动肺癌脑转移;
- 消化系统肿瘤(肝癌):METTL3高表达通过YTHDF2降解抑癌基因SOCS2的mRNA,促进肿瘤发生;WTAP高表达通过m⁶A-HuR通路抑制ETS1的翻译,推动肝癌细胞周期进展;
- 血液系统肿瘤(急性髓系白血病,AML):FTO高表达通过去甲基化ASB2、RARα等抑癌基因的mRNA,抑制白血病细胞分化;METTL3高表达结合SP1启动子,激活c-MYC表达,促进白血病增殖。
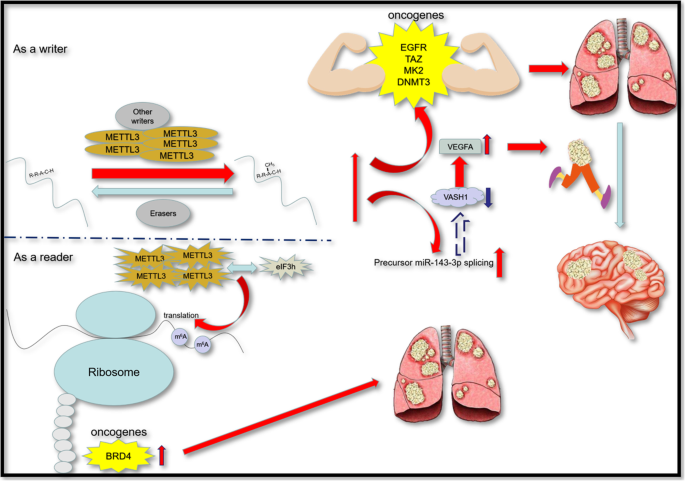
4. Biomarker研究及发现成果解析
本综述重点讨论了m⁶A调控因子作为肿瘤Biomarker的潜力,核心成果如下:
4.1 Biomarker的类型与筛选逻辑
文献中涉及的Biomarker均为m⁶A调控因子(writer、eraser、reader),其筛选逻辑遵循“临床样本表达差异→功能验证→预后关联”:
- 表达差异:通过TCGA数据库或临床队列分析,发现调控因子在肿瘤组织中的表达与正常组织存在显著差异(如METTL3在肝癌中高表达,FTO在宫颈癌中高表达);
- 功能验证:通过细胞系或动物模型,证明调控因子的表达变化直接影响肿瘤表型(如敲除METTL3抑制肝癌细胞增殖);
- 预后关联:通过生存分析,确认调控因子的表达水平与患者预后相关(如高表达METTL3的肝癌患者总生存期更短)。
4.2 核心Biomarker的成果总结
- 透明细胞肾癌(ccRCC):eraser(ALKBH5、FTO)的低表达与患者不良预后相关(风险比HR=1.5~2.0,P<0.05),是独立预后Biomarker;
- 急性髓系白血病(AML):FTO在MLL重排、FLT3-ITD等高危亚型中高表达,其表达水平与白血病细胞分化障碍及化疗耐药相关,可作为靶点预测治疗响应;
- 肝癌(HCC):writer(METTL3、WTAP、VIRMA)的高表达与肿瘤大小、血管侵犯及不良预后相关(5年生存率降低30%~40%,P<0.01);
- 前列腺癌:writer(VIRMA)的高表达通过m⁶A依赖方式促进长链非编码RNA CCAT1/2的表达,与肿瘤转移及复发相关(HR=2.1,P=0.003);
- 子宫内膜癌:writer(METTL3、METTL14)的低表达与AKT通路过度激活相关,其表达水平与肿瘤增殖指数(Ki-67)负相关(r=-0.45,P<0.05)。
4.3 创新性与临床价值
这些Biomarker的创新点在于首次将RNA表观遗传调控因子与肿瘤预后关联,突破了传统Biomarker(如蛋白、基因突变)的局限,为肿瘤的精准诊断提供了新维度。例如:
- 在AML中,FTO的表达水平可区分高危亚型,指导化疗方案选择;
- 在肝癌中,METTL3的高表达可作为术后复发的预测指标,提示患者需要强化辅助治疗。
综上,本综述系统总结了m⁶A RNA甲基化在癌症中的作用,明确了调控因子作为Biomarker及治疗靶点的潜力,为后续研究提供了重要的理论基础与转化方向。
