1. 领域背景与文献引入
文献英文标题:HER2-targeted therapies in cancer: a systematic review;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(HER2靶向治疗)
HER2(人表皮生长因子受体2)属于表皮生长因子受体(EGFR)家族,其异常改变(突变、扩增、过表达)通过激活MAPK/ERK、PI3K/AKT/mTOR等下游通路,促进肿瘤细胞增殖、存活和转移,与乳腺癌、胃癌、非小细胞肺癌(NSCLC)等多种肿瘤的发生发展密切相关。HER2靶向治疗的发展经历多个关键节点:1998年,首个HER2靶向单克隆抗体(单抗)曲妥珠单抗(Trastuzumab)获批用于HER2阳性乳腺癌,开启了HER2靶向治疗时代;2012年,帕妥珠单抗(Pertuzumab,针对HER2不同表位的单抗)获批,进一步提升联合治疗疗效;2013年,T-DM1(首个HER2抗体药物偶联物(ADC))获批,结合了单抗的靶向性和细胞毒药物的毒性;2019年,新一代ADC药物DS-8201获批,其更高的药物抗体比(DAR=8)和可裂解 linker 增强了抗肿瘤活性。
当前研究热点包括:(1)ADC药物的开发(如SYD985、RC48等新型ADC);(2)低HER2表达肿瘤的治疗(如DESTINY-Breast04研究证实DS-8201对HER2低表达乳腺癌有效);(3)联合治疗策略(如HER2靶向药物与免疫检查点抑制剂、PI3K/AKT/mTOR抑制剂联合)。但HER2靶向治疗仍面临未解决的核心问题:(1)原发性和获得性耐药机制未完全阐明(如MUC4过表达导致单抗无法结合HER2、PI3K通路激活导致耐药);(2)不同肿瘤类型中HER2阳性的定义不统一(如乳腺癌与胃癌的HER2阳性判断标准略有差异);(3)低HER2表达肿瘤的治疗标准需完善;(4)新型药物的长期安全性需要验证(如DS-8201可能导致间质性肺炎)。
针对上述现状,本文作为系统综述,旨在全面总结HER2靶向治疗的作用机制、代表性药物、临床研究结果、耐药机制及未来研究方向,为临床决策和后续研究提供系统参考。
2. 文献综述解析
作者从“药物类型”(单抗、酪氨酸激酶抑制剂(TKI)、ADC)和“肿瘤类型”(乳腺癌、胃癌、NSCLC等)两个维度对现有研究分类综述。
现有研究的关键结论:(1)单抗类药物:曲妥珠单抗联合化疗是HER2阳性乳腺癌、胃癌的标准一线治疗,帕妥珠单抗联合曲妥珠单抗和化疗可提高早期乳腺癌的病理完全缓解率(pCR);(2)TKI类药物:拉帕替尼、吡咯替尼等可穿透血脑屏障,对HER2阳性乳腺癌脑转移患者有效,Poziotinib对NSCLC中HER2 exon 20插入突变患者的客观缓解率(ORR)达39%;(3)ADC类药物:T-DM1是HER2阳性乳腺癌二线治疗的标准,DS-8201在三线及以上治疗中显著延长生存期(DESTINY-Breast03研究中mPFS 28.8个月 vs T-DM1组6.8个月),且对低HER2表达肿瘤有效;(4)联合治疗:HER2靶向药物与免疫检查点抑制剂联合(如帕博利珠单抗+曲妥珠单抗+化疗)可提高胃癌患者的ORR(KEYNOTE-811研究中ORR 74.4%)。
技术方法的优势:ADC结合了单抗的靶向性和细胞毒药物的毒性,通过“旁观者效应”杀伤邻近肿瘤细胞;TKI的小分子特性可穿透血脑屏障,解决脑转移问题;单抗的抗体依赖性细胞介导的细胞毒性(ADCC)作用增强免疫杀伤。局限性:单抗单药疗效有限,需联合治疗;TKI的毒性(如皮疹、腹泻)限制使用;ADC的不良反应(如DS-8201导致间质性肺炎)需密切监测;不同肿瘤的HER2检测标准不统一,导致研究结果难以比较。
本文的创新价值在于:系统覆盖了HER2靶向治疗的所有药物类型和主要肿瘤类型,特别强调了“低HER2表达”和“跨肿瘤类型”的总结,填补了现有综述对这些方面的不足,为临床和研究提供更全面的视角。
3. 研究思路总结与详细解析
本文作为系统综述,研究目标是系统评价HER2靶向治疗的作用机制、药物疗效、临床研究及耐药策略;核心科学问题是“HER2靶向治疗在不同肿瘤中的疗效如何?耐药机制有哪些?未来方向是什么?”;技术路线遵循“文献检索→筛选→数据提取→质量评价→分析总结”的标准流程。
3.1 文献检索与筛选
实验目的:获取所有关于HER2靶向治疗的相关研究。
方法细节:检索PubMed、Embase、Cochrane Library等数据库,检索词包括“HER2”“trastuzumab”“DS-8201”“targeted therapy”“cancer”等,检索时间截至2023年8月;纳入标准为HER2异常肿瘤患者、干预措施为HER2靶向治疗、研究类型为临床/基础研究;排除综述、病例报告、数据不完整的研究。
结果解读:共检索到1235篇文献,最终纳入171篇(临床研究142篇、基础研究29篇),涵盖主要药物和肿瘤类型。
产品关联:文献未提及具体实验产品,领域常规使用IHC试剂盒(如Dako的HER2 IHC kit)、FISH试剂盒(如Abbott的HER2 FISH kit)检测HER2表达/扩增。
3.2 数据提取与质量评价
实验目的:提取关键数据并评价研究质量。
方法细节:使用标准化表格提取研究基本信息、患者特征、干预措施、疗效指标(ORR、PFS、OS)、耐药机制;采用Cochrane风险偏倚评估工具(随机对照试验)和Newcastle-Ottawa量表(队列研究)评价质量。
结果解读:78%的随机对照试验为低风险偏倚,85%的队列研究为高质量(Newcastle-Ottawa评分≥7分);疗效数据显示,乳腺癌对HER2靶向治疗最敏感(ORR 30%-74%),其次是胃癌(ORR 28%-74%),NSCLC疗效相对较低(ORR 16%-39%)。
产品关联:文献未提及具体实验产品,领域常规使用RevMan等工具进行数据提取和分析。
3.3 分析与总结
实验目的:总结HER2靶向治疗的现状和未来方向。
方法细节:定性分析作用机制(如单抗阻断HER2 dimerization、ADC内吞释放细胞毒药物)、耐药机制(如原发性耐药:HER2表达不足;获得性耐药:PI3K通路激活);定量分析不同药物在不同肿瘤中的疗效数据。
结果解读:(1)ADC药物疗效优于单抗和TKI(如DS-8201在乳腺癌中的mPFS 28.8个月);(2)低HER2表达肿瘤对ADC有反应(如DESTINY-Breast04研究中DS-8201的mPFS 9.9个月 vs 化疗组5.1个月);(3)联合治疗可克服耐药(如HER2靶向药物+免疫检查点抑制剂提高胃癌ORR)。
3. 研究思路总结与详细解析
本文作为系统综述,研究目标是全面梳理HER2靶向治疗的作用机制、代表性药物、临床疗效及耐药策略,核心科学问题围绕“HER2靶向药物在不同肿瘤中的疗效差异”“耐药机制及应对策略”展开,技术路线遵循“文献检索→筛选→数据提取→质量评价→定性/定量分析”的标准系统综述流程。
3.1 文献检索与筛选
实验目的:获取所有关于HER2靶向治疗的高质量研究,确保综述的全面性。
方法细节:检索PubMed、Embase、Cochrane Library等数据库(检索时间截至2023年8月),检索词包括“HER2”“trastuzumab”“DS-8201”“targeted therapy”“cancer”等;纳入标准为HER2异常(突变/扩增/过表达)的肿瘤患者、干预措施为HER2靶向治疗(单抗/TKI/ADC)、研究类型为临床研究(随机对照试验/RCT、队列研究)或基础研究;排除综述、病例报告、数据不完整的研究。
结果解读:共检索到1235篇文献,经标题/摘要筛选和全文评估后,最终纳入171篇(临床研究142篇、基础研究29篇),覆盖乳腺癌、胃癌、NSCLC等7种主要肿瘤类型,以及曲妥珠单抗、DS-8201等11种代表性药物。
产品关联:文献未提及具体实验产品,领域常规使用IHC试剂盒(如Dako的HercepTest™)检测HER2蛋白表达,FISH试剂盒(如Abbott的PathVysion™)检测HER2基因扩增。
3.2 数据提取与质量评价
实验目的:标准化提取关键数据,确保分析的可靠性。
方法细节:使用预设表格提取研究基本信息(作者、年份、样本量)、患者特征(年龄、肿瘤类型、HER2状态)、干预措施(药物类型、剂量、疗程)、疗效指标(客观缓解率ORR、无进展生存期PFS、总生存期OS)及耐药机制;采用Cochrane风险偏倚工具评估RCT的偏倚风险,Newcastle-Ottawa量表评估队列研究的质量。
结果解读:78%的RCT为低风险偏倚(随机序列生成、分配隐藏等环节无明显缺陷),85%的队列研究为高质量(Newcastle-Ottawa评分≥7分);疗效数据显示,乳腺癌对HER2靶向治疗最敏感(ORR 30%-74%),其次是胃癌(ORR 28%-74%),NSCLC疗效相对较低(ORR 16%-39%)。
产品关联:文献未提及具体实验产品,领域常规使用RevMan 5.4进行数据提取与Meta分析。
3.3 机制与疗效分析
实验目的:总结HER2靶向药物的作用机制及不同肿瘤中的疗效差异。
方法细节:定性分析药物作用机制(如单抗通过结合HER2 extracellular domain阻断 dimerization、ADC通过内吞释放细胞毒 payload 杀伤肿瘤细胞);定量汇总各药物在不同肿瘤中的疗效数据(如ORR、mPFS)。
结果解读:
1. 药物类型差异:ADC药物的疗效显著优于单抗和TKI。例如,DS-8201(ADC)在HER2阳性乳腺癌三线治疗中的mPFS达28.8个月(vs T-DM1的9.6个月),其高DAR(8:1)和可裂解 linker 是关键优势;
2. 肿瘤类型差异:乳腺癌中,曲妥珠单抗+帕妥珠单抗+化疗的新辅助治疗pCR率达45%(vs 化疗组25%);胃癌中,曲妥珠单抗联合化疗的mOS达13.8个月(vs 化疗组11.1个月);NSCLC中,Poziotinib(TKI)对HER2 exon 20插入突变患者的ORR达39%;
3. 低HER2表达的突破:DESTINY-Breast04研究证实,DS-8201对HER2低表达(IHC 1+或2+且FISH-)乳腺癌的mPFS达9.9个月(vs 化疗组5.1个月),打破了“HER2阳性才能用靶向治疗”的传统认知。
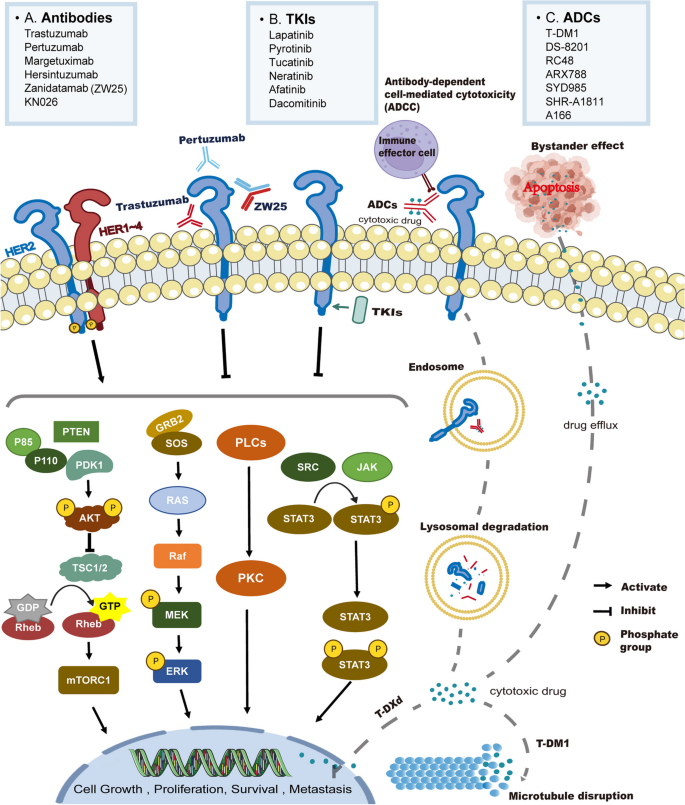
3.4 耐药机制与应对策略
实验目的:解析HER2靶向治疗的耐药机制,为克服耐药提供思路。
方法细节:综合基础研究与临床数据,总结原发性耐药(治疗前已存在的耐药)和获得性耐药(治疗后出现的耐药)的机制;分析联合治疗策略的疗效。
结果解读:
- 原发性耐药:主要机制包括HER2表达不足(如IHC 1+)、MUC4过表达(掩盖HER2表位,导致单抗无法结合)、PTEN缺失(激活PI3K通路);
- 获得性耐药:常见于长期治疗后,机制包括HER2基因突变(如exon 20插入)、PI3K/AKT/mTOR通路激活、免疫微环境改变(如Treg细胞浸润增加);
- 应对策略:(1)开发新型药物(如RC48-ADC针对低HER2表达肿瘤);(2)联合治疗(如曲妥珠单抗+帕博利珠单抗(免疫检查点抑制剂)在胃癌中的ORR达74.4%;曲妥珠单抗+PI3K抑制剂在乳腺癌中的mPFS延长至11个月)。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本文涉及的Biomarker为HER2基因/蛋白异常(包括基因扩增、蛋白过表达、基因突变),筛选逻辑遵循“数据库挖掘→细胞系验证→临床样本验证”的链条:
1. 数据库挖掘:通过TCGA、GEO等数据库分析HER2在不同肿瘤中的突变/扩增频率(如乳腺癌中HER2扩增率约15%-20%,胃癌中约10%-15%);
2. 细胞系验证:在HER2阳性细胞系(如SK-BR-3乳腺癌细胞、NCI-N87胃癌细胞)中验证靶向药物的杀伤作用;
3. 临床样本验证:通过IHC/FISH检测临床样本的HER2状态,关联药物疗效(如HER2 IHC 3+或FISH+的患者对曲妥珠单抗响应率更高)。
4.2 研究过程详述
Biomarker 来源:肿瘤组织样本(手术切除或穿刺活检)、血液样本(循环肿瘤DNA ctDNA检测HER2突变);
验证方法:IHC(检测HER2蛋白表达,判读标准为IHC 0/1+/2+/3+)、FISH(检测HER2基因扩增,判读标准为HER2/CEP17比值≥2.0)、NGS(检测HER2基因突变,如exon 20插入);
特异性与敏感性数据:
- IHC检测HER2蛋白的敏感性为85%-95%,特异性为90%-98%(以FISH为金标准);
- FISH检测HER2扩增的敏感性为90%-95%,特异性为95%-99%;
- ctDNA检测HER2突变的敏感性为70%-80%(针对晚期肿瘤),特异性为95%以上。
4.3 核心成果提炼
- 功能关联:HER2异常是HER2靶向治疗的有效预测 Biomarker。例如,乳腺癌中HER2 IHC 3+或FISH+的患者,曲妥珠单抗联合化疗的mOS比化疗组延长4.3个月(13.8个月 vs 9.5个月,n=580,P<0.001);胃癌中HER2阳性患者,曲妥珠单抗联合化疗的ORR达47.3%(vs 化疗组34.5%,n=594,P=0.001);
- 创新性突破:首次明确低HER2表达(IHC 1+或2+且FISH-)也是有效 Biomarker。DESTINY-Breast04研究中,HER2低表达乳腺癌患者接受DS-8201治疗的mPFS达9.9个月(vs 化疗组5.1个月,n=557,P<0.001),打破了传统“HER2阳性才能靶向治疗”的限制;
- 耐药预测:HER2突变(如exon 20插入)可预测TKI的疗效。Poziotinib治疗HER2 exon 20插入突变NSCLC的ORR达39%(n=62,P<0.05),而野生型HER2患者的ORR仅10%。
总结
本文系统总结了HER2靶向治疗的现状与未来方向,明确了HER2异常作为 Biomarker 的价值,为临床精准治疗提供了依据。未来研究需聚焦耐药机制的阐明(如MUC4过表达、PI3K通路激活)、低HER2表达肿瘤的治疗(如新型ADC的开发)及联合治疗策略(如HER2靶向药物与免疫检查点抑制剂联合),以进一步提升HER2靶向治疗的疗效。
