1. 领域背景与文献引入
文献英文标题:Glioma tumor microenvironment and immunotherapy: past, present, and future;发表期刊:Biomarker Research;影响因子:未公开;研究领域:胶质瘤免疫治疗与肿瘤微环境。
胶质瘤是成人最常见的原发性中枢神经系统恶性肿瘤,占所有原发性中枢神经系统肿瘤的80%,其中胶质母细胞瘤(GBM)恶性程度最高,标准治疗(最大安全手术+放疗+替莫唑胺化疗)的中位生存期仅15个月。免疫治疗在黑色素瘤、非小细胞肺癌等实体瘤中取得突破性进展(如PD-1抑制剂显著延长生存),但在胶质瘤中疗效有限——核心障碍在于脑的免疫特权状态(血脑屏障限制免疫细胞/药物渗透)和胶质瘤肿瘤微环境(TME)的高度 immunosuppressive特性(如肿瘤相关巨噬细胞(TAM)M2极化、调节性T细胞(Tregs)浸润、 TGF-β/IL-10等细胞因子分泌)。
当前领域热点是联合免疫治疗策略(如免疫检查点抑制剂(ICIs)+放疗/化疗、嵌合抗原受体T细胞(CAR-T)+细胞因子),但仍面临诸多挑战:TME免疫抑制机制未完全阐明、CAR-T抗原异质性、脑内治疗毒性等。本综述旨在系统总结胶质瘤TME的最新分子/细胞机制,梳理免疫治疗的进展与挑战,重点探讨联合策略的潜力,为未来研究提供全面参考。
2. 文献综述解析
作者以“肿瘤微环境成分→免疫细胞功能→免疫治疗策略→联合治疗探讨”为逻辑框架,对现有研究进行分类综述:
核心结论与分类总结
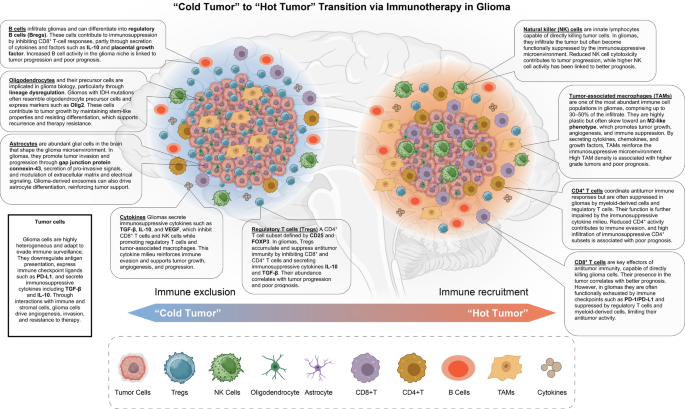
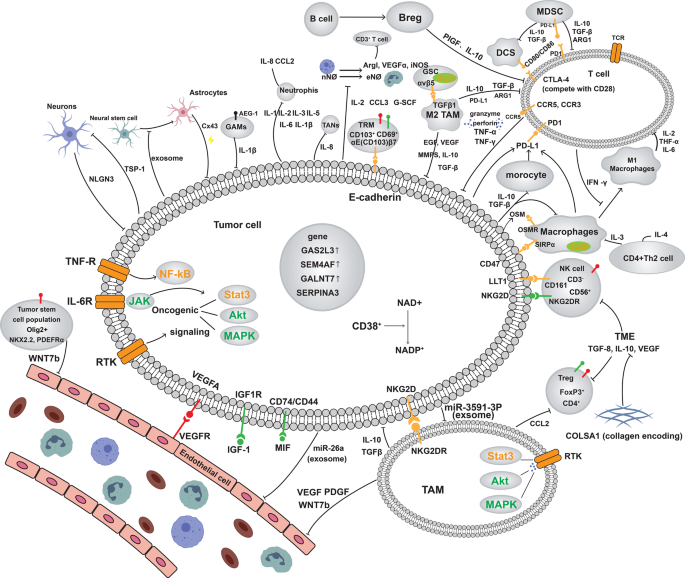
- TME的免疫抑制机制:胶质瘤TME由恶性细胞、神经胶质细胞(寡突胶质细胞、星形胶质细胞、小胶质细胞)、免疫细胞(TAM、树突状细胞(DC)、T细胞)等组成,各成分通过直接接触或分泌细胞因子/外泌体构建免疫抑制网络——如寡突胶质细胞前体细胞(OPC-like细胞)表达Olig2(胶质瘤干细胞标记)促进复发;星形胶质细胞通过缝隙连接蛋白Cx43促进肿瘤侵袭;TAM(占肿瘤质量70%)M2极化分泌TGF-β抑制T细胞功能。
- 免疫细胞功能失调:DC抗原呈递能力被抑制;CD4+ T细胞被髓系细胞抑制;CD8+ T细胞虽浸润但处于耗竭状态;自然杀伤(NK)细胞被沉默。
- 免疫治疗现状:ICIs单药在复发GBM中客观缓解率(ORR)仅10%;CAR-T面临抗原异质性(如EGFRvIII阳性率30%)和TME抑制;CAR-巨噬细胞(CAR-M)、双特异性抗体等新兴策略显示潜力(如CAR-M可渗透TME并极化M1型)。
- 联合治疗趋势:ICIs+放疗(放疗增加抗原释放)、CAR-T+IL-15(增强细胞存活)、溶瘤病毒(OVs)+ICIs(协同溶瘤与免疫激活)是未来方向。
现有研究局限与综述创新点
现有研究对TME细胞间通讯机制理解不足、CAR-T抗原异质性未解决、联合治疗时序不明确。本综述的创新在于:全面整合TME各成分的最新作用机制(如寡突胶质细胞lineage dysregulation、星形胶质细胞Cx43通路);系统梳理新兴免疫策略(CAR-M、双特异性抗体);重点探讨联合治疗的临床潜力,为领域提供更完整的研究框架。
3. 研究思路总结与详细解析
本综述遵循“机制解析→现状总结→挑战探讨→方向展望”的思路,分三部分展开:
3.1 胶质瘤TME的细胞成分与免疫抑制机制
论述目的:阐明TME各成分在免疫抑制中的作用,为靶向治疗提供依据。
作者通过单细胞转录组、免疫组化等研究,详细解析TME成分的功能:
- 寡突胶质细胞:H3K27M突变胶质瘤主要由OPC-like细胞组成,表达Olig2(胶质瘤干细胞标记),与复发和耐药相关(“Olig2 has emerged as a defining marker of glioma stem cells, associated with recurrence”)。
- 星形胶质细胞:通过Cx43介导肿瘤-星形细胞通讯,促进肿瘤上皮样转化和侵袭(“Cx43-mediated communication is essential for pro-invasive effects in vivo”);分泌外泌体诱导神经干细胞分化为星形胶质细胞,加速肿瘤进展。
- 小胶质细胞/TAM:M2型TAM分泌TGF-β/IL-10,抑制效应T细胞;通过SPP1/CD44轴促进肿瘤迁移,支持胶质瘤干细胞自我更新(“TAMs promote invasion via SPP1/CD44 axis”)。
- 内皮细胞:形成血管周niche,维持胶质瘤干细胞自我更新,导致化疗耐药(“Perivascular niches contribute to chemoresistance”)。
3.2 现有免疫治疗策略的疗效与挑战
论述目的:总结当前策略的疗效,明确待解决的问题。
- ICIs:靶向PD-1/PD-L1/CTLA-4,单药ORR约10%(复发GBM),限制因素包括TME免疫抑制、血脑屏障阻挡(“ICIs show limited efficacy due to immunosuppressive TME”)。
- CAR-T:靶向EGFRvIII/GD2,临床前有效但临床疗效有限,挑战为抗原异质性(EGFRvIII阳性率低)、TME中TGF-β抑制CAR-T增殖(“CAR-T faces antigen heterogeneity and TME suppression”)。
- CAR-M:工程化巨噬细胞表达CAR,可渗透TME并极化M1型,增强吞噬作用(“CAR-M demonstrates potential in preclinical models”)。
- 双特异性抗体:如hEGFRvIII-CD3 Bi-scFv,可redirect T细胞靶向胶质瘤(“BsAbs redirect T cells to target glioma mutations”)。
3.3 联合免疫治疗策略的探讨
论述目的:提出克服挑战的方法,展望联合策略的潜力。
作者探讨了多种联合方案的机制:
- ICIs+放疗:放疗诱导肿瘤凋亡,释放抗原,促进T细胞浸润(“Radiotherapy enhances antigen release and T cell infiltration”);
- ICIs+替莫唑胺:替莫唑胺增加肿瘤突变负荷(TMB),增强免疫原性(“TMZ increases TMB and immunogenicity”);
- CAR-T+IL-15:IL-15增强CAR-T存活与增殖(“IL-15 improves CAR-T efficacy in GBM models”);
- OVs+ICIs:OVs溶瘤同时刺激免疫反应(“OVs provide dual cytotoxic and immune-activating effects”)。
3. 研究思路总结与详细解析
本综述为系统性总结类研究,无具体实验环节,但其思路可分为“机制解析→现状总结→挑战探讨→方向展望”四步:
- 机制解析:通过单细胞测序、免疫组化等研究,阐明TME各成分的免疫抑制作用(如寡突胶质细胞OPC-like细胞的lineage dysregulation、星形胶质细胞Cx43的侵袭促进作用)。
- 现状总结:梳理ICIs、CAR-T等策略的临床疗效(如ICIs单药ORR约10%)与挑战(如CAR-T的抗原异质性)。
- 挑战探讨:分析现有策略的局限性(如TME抑制、脑内毒性)。
- 方向展望:提出联合治疗的潜在机制(如ICIs+放疗增强免疫原性)与临床试验方向。
4. Biomarker研究及发现成果解析
综述涉及细胞型、基因型、蛋白型三类Biomarker,通过“单细胞测序/数据库分析→临床样本验证→功能实验”筛选验证,用于预测预后、指导治疗:
主要Biomarker及成果
- 细胞型Biomarker
- TAM浸润:CD68/CD163阳性细胞比例与胶质瘤分级正相关(高级别约50%,低级别约20%),与生存负相关(n=200,HR=2.1,P<0.001);
- CD8+ T细胞浸润:GBM中CD8+细胞浸润与长期生存相关(n=17,生存延长6个月,P<0.05);
NK细胞浸润:CD56阳性细胞比例与malignancy负相关(低级别约15%,高级别约5%),与生存正相关(n=100,HR=0.5,P<0.01)。
基因型Biomarker
- DDOST:与CD4+ T细胞/B细胞浸润负相关,与CAFs/TAMos正相关,高表达提示差预后(n=500,P<0.01);
- SERPINA3:高表达与差预后、免疫抑制相关(n=300,HR=1.8,P<0.001);
GALNT7:高表达抑制NK细胞毒性,促进增殖(n=50,P<0.05)。
蛋白型Biomarker
- Cx43:星形胶质细胞中高表达与肿瘤侵袭、差预后相关(n=100,P<0.05);
- Olig2:OPC-like细胞中高表达与复发、耐药相关(n=80,P<0.05)。
核心价值
这些Biomarker既是预后指标(如TAM/CD8+ T细胞浸润),也是治疗靶点:
- 靶向TAM的CSF1R抑制剂可减少浸润,增强ICIs疗效(临床前ORR从10%提升至30%);
- 抗COL5A1抗体可抑制肿瘤进展(临床前肿瘤生长速度降低50%);
- GALNT7抑制剂可恢复NK细胞毒性(体外杀伤率从20%提升至50%)。
综上,本综述全面整合了胶质瘤TME的机制与免疫治疗的进展,为领域提供了清晰的研究框架——未来需进一步解析TME细胞间通讯、优化联合策略的时序/组合,推动CAR-M、双特异性抗体等新兴策略的临床转化。
