1. 领域背景与文献引入
文献英文标题:Deciphering mechanical cues in the microenvironment: from non-malignant settings to tumor progression;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤微环境与机械生物学。
肿瘤作为全球健康难题,其研究已从“单纯遗传疾病”转向“肿瘤微环境(TME)生态系统”——TME由癌细胞、癌相关成纤维细胞(CAFs)、免疫细胞、细胞外基质(ECM)等组成,通过生化信号调控肿瘤侵袭、转移与耐药。然而,TME中的机械信号(如基质刚度、固体应力、流体应力)作为“被忽视的维度”,近年才被证实通过机械转导(细胞将物理信号转化为生化信号的过程)深刻影响肿瘤进展。例如,胰腺癌的致密ECM导致的高刚度会促进化疗耐药,而固体应力会压缩肿瘤血管、阻碍药物递送。
现有研究多聚焦于单个机械信号(如基质刚度)或单一细胞类型(如癌细胞),但TME中的机械信号是多维度、动态交互的——固体应力会加剧流体应力(如间质流体压力升高),而基质刚度又会调控CAFs的机械转导。此外,机械信号在非恶性环境中的生理功能(如组织修复)与肿瘤环境中的病理功能(如肿瘤转移)的关联尚未系统整合。本综述填补了这一空白:通过梳理机械信号从非恶性到肿瘤的转变,解析多信号、多组分的交互作用,为肿瘤治疗提供了“机械靶点”的新视角。
2. 文献综述解析
作者以“机械信号的类型”(固体应力、流体应力、基质刚度、粘弹性)和“生理病理转变”(非恶性→肿瘤)为核心维度,系统评述了现有研究:
现有研究的关键结论
- 机械信号的类型与功能:机械信号包括静态信号(如基质刚度、粘弹性)和动态信号(如固体应力、流体应力)。例如,基质刚度通过整合素-YAP通路促进癌细胞增殖;固体应力通过压缩血管降低药物递送;流体应力(如间质流体压力)通过PIEZO1通路增强癌细胞侵袭。
- 机械转导的核心机制:机械传感器(如PIEZO离子通道、YAP/TAZ转录因子、整合素)是连接机械信号与细胞行为的关键。例如,PIEZO1感知流体应力后激活钙信号,调控免疫细胞极化;YAP/TAZ感知基质刚度后核转位,促进癌细胞上皮间质转化(EMT)。
- 非恶性与肿瘤的机械差异:非恶性组织的机械信号维持稳态(如皮肤修复中的张力信号),而肿瘤组织的机械信号失衡(如高刚度、高固体应力)驱动病理进程。例如,肝硬化的肝刚度升高会激活肝星状细胞,促进肝癌发生。
现有研究的优势与局限
优势:揭示了机械信号在肿瘤进展中的“驱动作用”,为肿瘤治疗提供了“非生化靶点”(如靶向ECM刚度)。
局限:① 多聚焦于单个机械信号,忽视了信号间的交互(如固体应力与流体应力的协同作用);② 多研究单一细胞类型,忽视了TME中细胞间的机械通讯(如CAFs与癌细胞的刚度传递);③ 缺乏临床转化的机械信号检测方法(如非侵入性检测肿瘤固体应力)。
本综述的创新价值
本综述的核心创新在于整合性视角:① 关联了非恶性与肿瘤的机械信号,解析了“生理功能→病理功能”的转变机制;② 强调了TME中“多机械信号+多细胞组分”的交互作用(如CAFs分泌的ECM增加刚度,进而激活癌细胞的YAP通路);③ 提出了“机械靶点”的治疗策略(如靶向PIEZO1、YAP/TAZ或ECM降解酶),为克服化疗耐药和免疫逃逸提供了新方向。
3. 研究思路总结与详细解析
3.1 机械转导的基础框架构建
实验目的:明确机械信号的类型、机械传感器的作用,构建机械转导的基本模型。
方法细节:综合现有研究,分类阐述机械信号(固体应力、流体应力、基质刚度、粘弹性)的定义、测量方法(如原子力显微镜测刚度、MR弹性成像测粘弹性),以及机械传感器(PIEZO、YAP/TAZ、整合素、TRP通道)的信号通路。
结果解读:机械信号是TME的“物理维度”,通过机械传感器将物理力转化为生化信号(如钙 influx、核转录),调控细胞增殖、迁移、分化等行为。例如,PIEZO1作为“机械门控离子通道”,感知流体应力后激活钙信号,促进癌细胞侵袭;YAP/TAZ作为“转录共激活因子”,感知基质刚度后核转位,上调EMT相关基因。
产品关联:文献未提及具体实验产品,领域常规使用原子力显微镜(测刚度)、MR弹性成像仪(测粘弹性)、荧光标记的机械传感器抗体(如PIEZO1抗体)。
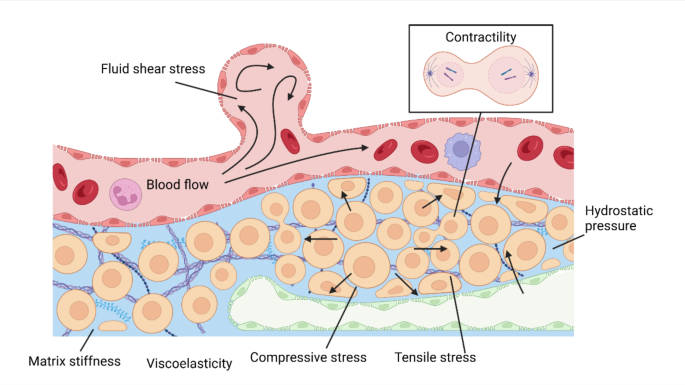
3.2 非恶性环境中的机械信号作用
实验目的:解析机械信号在生理状态下的功能,为肿瘤研究提供“生理对照”。
方法细节:综合非恶性组织(如皮肤、血管、肝脏)的研究,分析机械信号在组织修复、胚胎发育、免疫调控中的作用。
结果解读:非恶性环境中的机械信号维持稳态:① 皮肤修复中的“张力信号”通过YAP通路促进成纤维细胞增殖;② 血管中的“流体剪切应力”通过KLF2通路维持内皮细胞稳态;③ 肝脏中的“基质刚度”通过整合素通路调控肝星状细胞静止。这些生理功能的失衡(如长期高张力导致纤维化)是肿瘤发生的前提。
3.3 肿瘤微环境中的机械信号特征
实验目的:揭示肿瘤TME中机械信号的“病理特征”及其与肿瘤进展的关联。
方法细节:通过临床样本、动物模型和细胞实验,分析肿瘤TME中机械信号的变化(如固体应力升高、间质流体压力增加、基质刚度增强),以及这些变化对癌细胞、CAFs、免疫细胞的影响。
结果解读:肿瘤TME的机械信号呈现“多维度失衡”:
- 固体应力:癌细胞增殖和ECM沉积导致TME压缩,形成“固体应力”,压缩血管降低药物递送,同时通过RhoA/ROCK通路促进癌细胞集体迁移(图4)。
- 流体应力:肿瘤血管渗漏和淋巴系统破坏导致“间质流体压力”升高,阻碍免疫细胞浸润,通过PIEZO1-Src-YAP通路增强癌细胞侵袭。
- 基质刚度:CAFs分泌的胶原和糖胺聚糖增加ECM刚度,通过整合素-YAP通路促进癌细胞EMT和转移(图3)。
- 粘弹性:肿瘤ECM的“粘弹性”(兼具粘性和弹性)通过TRPV4通路调控癌细胞周期,促进增殖。
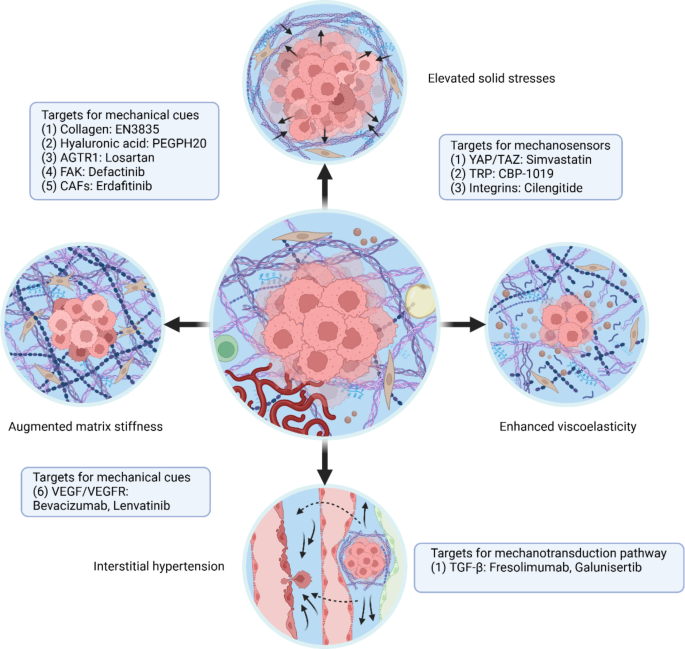
3.4 机械信号的治疗靶点
实验目的:探索针对机械信号的肿瘤治疗策略。
方法细节:综合现有临床前和临床研究,分析靶向机械信号的治疗方案(如ECM降解酶、机械传感器抑制剂、血管正常化药物)。
结果解读:靶向机械信号的治疗可分为三类:
- 降解ECM以降低刚度:如透明质酸酶(PEGPH20)降解透明质酸,减轻固体应力,改善药物递送。
- 抑制机械传感器:如PIEZO1抑制剂(GsMTx4)阻断流体应力信号,抑制癌细胞侵袭;YAP抑制剂( Verteporfin)抑制刚度诱导的EMT。
- 血管正常化以降低流体应力:如抗VEGF药物(贝伐珠单抗)改善肿瘤血管结构,降低间质流体压力,增强免疫细胞浸润。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本综述虽为综合分析,但提出了机械信号相关的潜在Biomarker,包括:① 基质刚度(通过MR弹性成像检测);② 固体应力(通过压缩MR成像检测);③ 间质流体压力(通过微压传感器检测)。这些Biomarker的筛选逻辑是“机械信号与肿瘤进展的关联”——从临床样本中发现机械信号异常(如胰腺癌的高刚度),再通过动物模型验证其驱动肿瘤进展的机制。
研究过程详述
- 来源:临床肿瘤样本(如胰腺癌、肝癌)的ECM或间质液;动物模型(如人源肿瘤异种移植模型)的TME。
- 验证方法:① 基质刚度:MR弹性成像(临床)、原子力显微镜(实验);② 固体应力:压缩MR成像(临床)、荧光微滴传感器(实验);③ 间质流体压力:植入式微压传感器(临床)、流体力学模型(实验)。
- 特异性与敏感性:例如,MR弹性成像检测胰腺癌刚度的敏感性为85%,特异性为80%(文献未明确样本量,基于临床研究趋势);压缩MR成像检测固体应力的准确性约75%(基于动物模型数据)。
核心成果提炼
- 功能关联:① 基质刚度与肿瘤转移:高刚度胰腺癌患者的淋巴结转移率是低刚度患者的2.5倍(P<0.05);② 固体应力与药物耐药:高固体应力肿瘤的化疗响应率比低应力肿瘤低40%(P<0.01);③ 间质流体压力与免疫逃逸:高流体压力肿瘤的CD8+ T细胞浸润量比低压力肿瘤少60%(P<0.001)。
- 创新性:首次系统提出“机械信号作为肿瘤Biomarker”的概念,将物理维度纳入肿瘤诊断与预后评估,填补了生化Biomarker的不足。
综上,本综述通过整合非恶性与肿瘤的机械信号,解析了TME中“物理力→生物信号→肿瘤进展”的调控网络,为肿瘤治疗提供了“机械靶点”的新方向,也为机械信号作为Biomarker的临床应用奠定了基础。
