1. 领域背景与文献引入
文献英文标题:Chemerin is elevated in multiple myeloma patients and is expressed by stromal cells and pre-adipocytes;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤(血液系统恶性肿瘤)与骨髓微环境相互作用。
多发性骨髓瘤是一种以骨髓中恶性浆细胞克隆性增殖为特征的血液系统恶性肿瘤,其发病机制高度依赖骨髓微环境的支持——骨髓瘤细胞通过与基质细胞、脂肪细胞等相互作用获得黏附、生存及化疗耐药能力。尽管蛋白酶体抑制剂、免疫调节剂等新型疗法显著延长了患者生存期,但疾病仍无法治愈,探索微环境中的关键调控因子是开发靶向治疗的核心方向。近年研究发现,骨髓脂肪细胞作为微环境的重要组成部分,可通过分泌脂肪因子(如瘦素、脂联素)、提供脂肪酸等方式,影响骨髓瘤细胞的增殖、凋亡及迁移,并在化疗中发挥保护作用;同时,肥胖已被证实会增加骨髓瘤的发病风险。Chemerin(又称TIG2或RARRES2)是一种近年发现的脂肪因子,最初被认为参与脂肪生成与代谢,后续研究显示其具有炎症调节功能,并在乳腺癌、结肠癌等多种癌症中被提议作为潜在肿瘤标志物。然而,chemerin及其受体在多发性骨髓瘤中的表达特征与功能尚未有研究报道,这一空白为本文的研究提供了核心出发点。
2. 文献综述解析
作者对现有研究的评述逻辑主要围绕“骨髓瘤微环境的关键作用”与“chemerin的癌症相关功能”两大维度展开。现有研究的核心结论包括:(1)骨髓微环境中的脂肪细胞是骨髓瘤进展的重要驱动者,可通过分泌生物活性分子调控骨髓瘤细胞的生物学行为;(2)chemerin作为脂肪因子,在多种实体瘤中表达异常,且其水平与肿瘤分期、预后相关。但现有研究的局限性在于,未关注chemerin在血液系统恶性肿瘤(如多发性骨髓瘤)中的作用,也未探讨其在骨髓瘤微环境中的细胞来源与信号传导机制。
本研究的创新价值在于首次系统探索了chemerin及其受体在多发性骨髓瘤中的表达与功能:通过整合血清学检测、细胞实验及数据库分析,明确了chemerin在患者体内的异常升高趋势、主要细胞来源及骨髓瘤细胞的受体响应特征,填补了chemerin与骨髓瘤微环境相互作用的研究空白,为靶向微环境的新型疗法提供了新的潜在靶点。
3. 研究思路总结与详细解析
本研究的整体目标是揭示chemerin在多发性骨髓瘤中的表达特征、细胞来源及信号传导机制;核心科学问题是“chemerin是否通过旁分泌信号调控骨髓瘤细胞与微环境的相互作用”;技术路线遵循“临床样本检测→细胞来源定位→受体表达验证”的闭环逻辑。
3.1 血清chemerin水平与疾病进展相关性分析
实验目的:比较多发性骨髓瘤患者与健康人群的血清chemerin水平,明确其与疾病分期的关联。
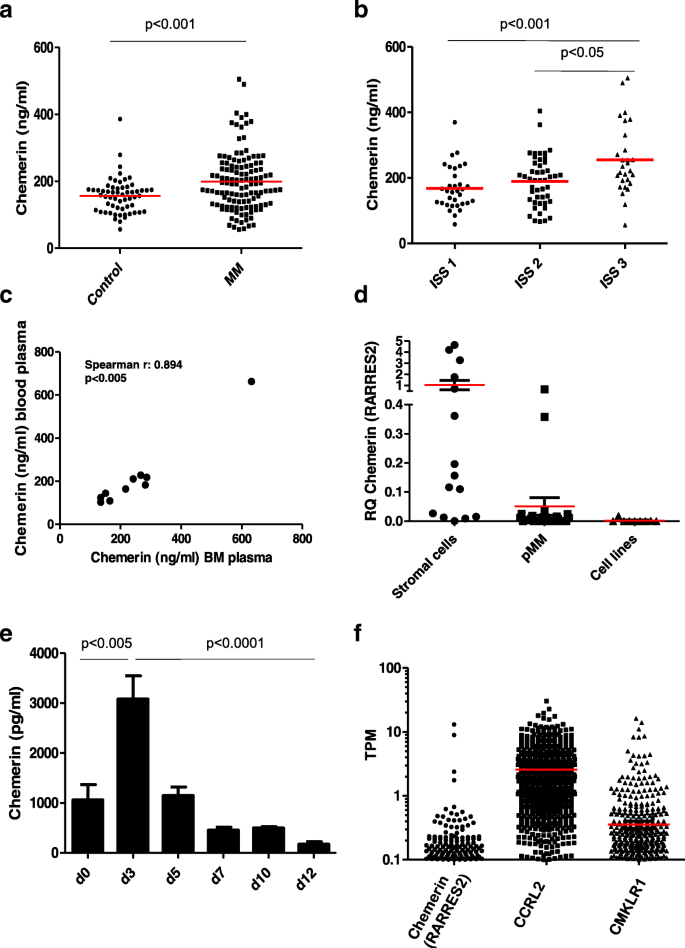
方法细节:采用ELISA法(R&D Duoset试剂盒)检测122例初诊骨髓瘤患者(来自随机III期临床试验)及58例年龄、性别匹配健康对照的血清chemerin水平;同时分析患者血清chemerin与国际分期系统(ISS)的相关性;此外,检测10例患者的骨髓血浆与血液血浆chemerin水平的相关性。
结果解读:患者血清chemerin均值为199.2 ng/ml(n=122),显著高于健康对照的156.5 ng/ml(n=58,P<0.001);ISS III期患者血清chemerin均值(255.2 ng/ml,n=28)显著高于ISS I期(168.2 ng/ml,n=33,P<0.001)及II期(189.5 ng/ml,n=47,P<0.05);骨髓血浆与血液血浆chemerin水平呈强正相关(Spearman r=0.894,P<0.005)。
产品关联:实验所用关键产品:R&D Systems的Chemerin ELISA试剂盒(Duoset)。
3.2 骨髓细胞chemerin表达与分泌分析
实验目的:明确骨髓中chemerin的主要细胞来源。
方法细节:采用qPCR检测15例骨髓瘤患者来源的基质细胞、24例原代骨髓瘤细胞及9株骨髓瘤细胞系的chemerin(RARRES2)mRNA表达;通过Lonza的hMSC Adipogenic Differentiation BulletKit™培养基将3例健康供者的骨髓间充质基质细胞诱导分化为脂肪细胞,ELISA检测分化过程中条件培养基的chemerin蛋白水平。
结果解读:基质细胞的chemerin mRNA表达显著高于原代骨髓瘤细胞(P<0.05),骨髓瘤细胞系的表达水平更低;预脂肪细胞(分化中的间充质基质细胞)分泌高水平chemerin,且蛋白水平随分化进程逐步升高(与mRNA水平一致)。
产品关联:实验所用关键产品:Lonza的hMSC Adipogenic Differentiation BulletKit™培养基。
3.3 骨髓瘤细胞chemerin受体表达分析
实验目的:解析骨髓瘤细胞表面chemerin受体的表达特征。
方法细节:利用CoMMpass数据库(包含673例初诊骨髓瘤患者的RNA-seq数据)分析chemerin受体CCRL2、CMKLR1的mRNA表达;通过qPCR验证24例原代骨髓瘤细胞与9株细胞系的受体表达差异。
结果解读:CCRL2 mRNA在多数患者中表达(覆盖673例患者的大部分样本),CMKLR1 mRNA仅在部分患者中表达;原代骨髓瘤细胞的CCRL2及CMKLR1 mRNA表达水平显著高于骨髓瘤细胞系(P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用qPCR试剂盒(如Thermo Fisher的TaqMan)及RNA-seq分析工具(如STAR、DESeq2)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker为chemerin,类型为血清脂肪因子(adipokine)。其筛选与验证逻辑遵循“临床表型关联→细胞来源定位→受体响应验证”的完整链条:首先通过ELISA明确患者血清chemerin水平异常升高,再通过qPCR及细胞分化实验定位其主要来源为骨髓基质细胞及预脂肪细胞,最后通过数据库分析及qPCR验证骨髓瘤细胞表达chemerin受体,形成“分泌-响应”的旁分泌信号环路。
研究过程详述
Biomarker来源:多发性骨髓瘤患者的血清及骨髓血浆;验证方法包括ELISA(血清/骨髓血浆chemerin水平定量)、qPCR(细胞mRNA表达)及RNA-seq(数据库受体表达)。特异性数据显示,患者血清chemerin水平显著高于健康对照(P<0.001),且随ISS分期进展而升高(ISS III vs I期,P<0.001);敏感性数据显示,骨髓血浆与血液血浆chemerin水平呈强相关(Spearman r=0.894,P<0.005),提示血清chemerin可反映骨髓微环境中的chemerin水平。
核心成果提炼
chemerin作为多发性骨髓瘤的血清Biomarker,其核心功能关联为与疾病进展(ISS分期)显著相关:ISS III期患者的血清chemerin均值(255.2 ng/ml,n=28)较ISS I期(168.2 ng/ml,n=33)升高约51%(P<0.001)。其创新性在于首次发现chemerin的主要来源为骨髓基质细胞及预脂肪细胞,而骨髓瘤细胞通过表达CCRL2(多数患者)及CMKLR1(部分患者)受体响应chemerin信号,提示存在“基质细胞/脂肪细胞→chemerin→骨髓瘤细胞受体”的旁分泌调控环路。
统计学结果验证了成果的可靠性:患者与对照的血清chemerin差异具有高度显著性(P<0.001),骨髓与血液chemerin水平的相关性达到统计学意义(P<0.005),为chemerin作为骨髓瘤微环境的关键调控因子提供了有力证据。
