1. 领域背景与文献引入
文献英文标题:Clinical significance of intronic variants in BRAF inhibitor resistant melanomas with altered BRAF transcript splicing;发表期刊:Biomark Res;影响因子:未公开;研究领域:黑色素瘤靶向治疗耐药机制。
BRAF是一种丝氨酸/苏氨酸激酶,在40%-60%的 cutaneous黑色素瘤中发生突变并持续激活。选择性BRAF抑制剂(如维莫非尼、达拉非尼)显著改善了BRAF突变黑色素瘤患者的无进展生存和总生存[1,2]。然而,多数患者会出现获得性耐药,已报道的耐药机制多涉及丝裂原活化蛋白激酶(MAPK)通路的再激活,如MEK1、BRAF或N-RAS的改变[3]。其中,BRAF的可变剪接是最常见的耐药驱动机制,约30%的耐药黑色素瘤中存在该机制[4-6]。BRAF剪接变体编码的蛋白缺乏完整的RAS结合域,易发生二聚化,对I类BRAF抑制剂(如维莫非尼、达拉非尼)的亲和力降低[4],导致MAPK通路在BRAF抑制剂存在下仍被激活,但对下游MEK、ERK抑制剂仍敏感[5,7]。
此前有研究在一株维莫非尼耐药黑色素瘤细胞系中发现,BRAF exon4-8缺失剪接变体(BRAF exon4-8∆)的表达与内含子8中距exon9上游51核苷酸处的一个分支点突变(C>G)相关[8]。但该突变的临床相关性尚未在患者来源的肿瘤样本中验证,且其对剪接的影响及与临床耐药的关联尚不明确。因此,本研究旨在探讨患者来源的BRAF抑制剂耐药黑色素瘤中,BRAF exon4-8∆剪接变体的表达是否与该内含子突变相关,并进一步确认表达该变体的细胞对MEK抑制剂的敏感性,为临床治疗策略提供依据。
2. 文献综述解析
文献综述部分围绕BRAF抑制剂的临床应用与耐药问题展开,核心评述逻辑为:首先阐述BRAF突变在黑色素瘤中的高频发生(40%-60%)及BRAF抑制剂的治疗价值,随后分类总结耐药机制(重点关注可变剪接这一最常见机制),接着评述此前关于内含子突变驱动剪接变体的研究(单细胞系证据),最后指出该研究的局限性——缺乏临床样本验证。
现有研究的关键结论包括:BRAF抑制剂通过靶向突变BRAF显著改善患者生存,但多数患者会出现获得性耐药;耐药机制主要通过MAPK通路再激活实现,其中BRAF可变剪接导致的剪接变体因缺乏RAS结合域、易二聚化而对BRAF抑制剂耐药;此前一项细胞系研究发现内含子8-51位C>G突变可促进BRAF exon4-8∆剪接变体的表达[8]。现有研究的技术方法优势在于明确了BRAF剪接变体的结构与功能特征,以及其对BRAF抑制剂耐药的机制;局限性则是该内含子突变的临床相关性未得到验证,且可变剪接导致的耐药对MEK抑制剂的敏感性需在更多患者来源样本中确认。
本研究的创新价值在于:首次在患者来源的BRAF抑制剂耐药黑色素瘤样本中分析BRAF exon4-8∆剪接变体与内含子8-51位突变的关联,弥补了此前单细胞系研究的局限性;同时,通过患者来源细胞系实验进一步确认了表达该剪接变体的细胞对MEK抑制剂的敏感性,为临床联合治疗策略提供了直接的实验依据。
3. 研究思路总结与详细解析
本研究的整体框架为:以“BRAF抑制剂耐药黑色素瘤中BRAF exon4-8∆剪接变体的分子机制及治疗敏感性”为核心科学问题,首先通过患者样本验证内含子8-51位突变与剪接变体的关联,随后通过生物信息学分析预测突变的剪接影响,最后通过细胞实验验证剪接变体对MEK抑制剂的敏感性,形成“临床样本观察→机制预测→细胞功能验证”的闭环。
3.1 患者来源耐药黑色素瘤样本的BRAF剪接变体检测与内含子序列分析
实验目的是验证患者进展期黑色素瘤中BRAF exon4-8∆剪接变体的表达及对应的内含子8-51位序列是否存在突变。实验方法为:纳入3例BRAF V600突变、接受BRAF抑制剂(达拉非尼或维莫非尼)单药治疗后进展的转移性黑色素瘤患者,收集 pretreatment和进展期(Prog)肿瘤样本;提取样本RNA,通过PCR检测BRAF exon4-8∆剪接变体的表达;提取DNA,通过Sanger测序分析内含子8中距exon9上游51核苷酸处的序列。实验结果显示:3例患者的进展期样本均表达BRAF exon4-8∆剪接变体,而pretreatment样本均未表达;但所有进展期样本的内含子8-51位序列均为野生型(C),未检测到C>G突变(图1)
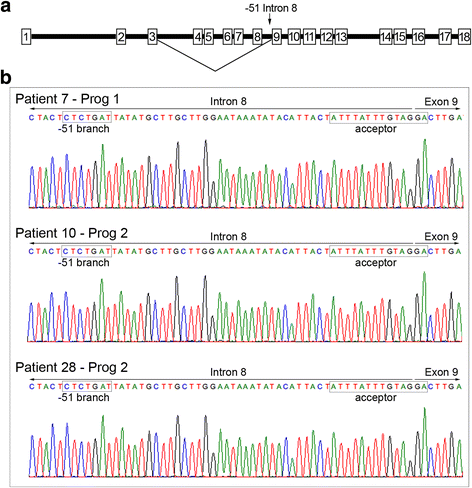
。实验所用关键产品:Taq polymerase(Fisher Biotech)、QIAquick PCR纯化试剂盒(Qiagen,货号未提及)、3730xl DNA分析仪(AGRF,Westmead, NSW, Australia)。
3.2 内含子8-51位突变的剪接影响预测分析
实验目的是明确C>G突变对BRAF前体mRNA剪接的潜在影响。实验方法为:使用Human Splicing Finder软件分析-51位C>G突变对分支点结构、剪接因子结合位点及隐蔽剪接位点的影响;同时对比人类分支点疾病突变数据库(包含66个内含子分支点疾病突变),分析该突变位置的保守性。实验结果显示:该突变不破坏分支点结构,也不改变剪接因子的结合;虽可能激活一个隐蔽供体位点,但该位点的使用不会产生BRAF exon4-8∆剪接变体;此外,人类疾病相关的分支点突变多发生在高度保守的腺嘌呤残基(对应本研究中的-48位),而非-51位[9]。实验所用关键产品:Human Splicing Finder软件(在线工具)。
3.3 表达BRAF剪接变体的黑色素瘤细胞对MEK抑制剂的敏感性验证
实验目的是确认表达BRAF剪接变体的BRAF抑制剂耐药细胞对MEK抑制剂的敏感性。实验方法为:使用两株患者来源的达拉非尼耐药细胞系(WMD009、SMU027),以及SKMel28 parental细胞系和其达拉非尼耐药亚系BR4;用不同浓度的达拉非尼(BRAF抑制剂)或曲美替尼(MEK抑制剂)处理细胞72小时,以DMSO处理为对照,检测细胞相对活力(mean ± SD,n=2)。实验结果显示:所有耐药细胞系对达拉非尼均表现出耐药(高浓度下活力仍较高),但对曲美替尼敏感,细胞活力随曲美替尼浓度增加而显著降低(Additional file 2: Figure S2,文献未明确提供具体数值,基于图表趋势推测)。实验所用关键产品:细胞培养用Dulbecco’s Modified Eagle Medium(DMEM)培养基(Gibco-BRL),药物达拉非尼、曲美替尼为FDA批准的临床药物,无具体试剂品牌的其他信息。
4. Biomarker研究及发现成果解析
本研究中的Biomarker为BRAF exon4-8缺失剪接变体(BRAF exon4-8∆),属于转录本水平的Biomarker。其筛选逻辑为:基于此前细胞系研究中发现的剪接变体[8],通过患者样本PCR检测筛选出进展期肿瘤中表达该变体的样本,再通过Sanger测序验证对应的内含子8-51位序列是否存在突变;验证逻辑为“临床样本表达检测→内含子序列验证→细胞功能敏感性验证”。
Biomarker的来源为患者的黑色素瘤组织样本(pretreatment和进展期),验证方法包括:PCR检测RNA水平的剪接变体表达,Sanger测序检测DNA水平的内含子序列,细胞活力实验检测对MEK抑制剂的敏感性。特异性数据显示:3例患者的进展期样本均表达BRAF exon4-8∆剪接变体,而pretreatment样本均未表达(n=3),说明该变体在BRAF抑制剂耐药样本中具有较高的特异性;敏感性数据因样本量较小(n=3)未进行统计分析,但细胞实验显示表达该变体的细胞对MEK抑制剂敏感(活力随药物浓度增加而降低,n=2)。
核心成果包括:(1)BRAF exon4-8∆剪接变体是BRAF抑制剂耐药黑色素瘤的一个功能性Biomarker,但其表达与内含子8-51位C>G突变无关,说明存在其他驱动剪接变体的机制;(2)表达该变体的黑色素瘤细胞对MEK抑制剂(如曲美替尼)仍敏感,提示联合使用BRAF和MEK抑制剂可能延缓或克服该机制导致的耐药;(3)首次在患者样本中证实了BRAF可变剪接耐药机制的临床相关性,且不依赖于此前报道的内含子突变。创新性在于:明确了该剪接变体作为耐药Biomarker的临床意义,且其对MEK抑制剂的敏感性为临床治疗提供了新的策略依据。
参考文献(注:文中[1]-[9]对应原文献参考文献列表,此处未逐一列出)
