1. 领域背景与文献引入
文献英文标题:Computation strategies and clinical applications in neoantigen discovery towards precision cancer immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(新抗原发现与应用)。
肿瘤免疫治疗是癌症治疗的突破性方向,涵盖免疫检查点抑制剂(ICIs)、过继细胞疗法(ACT)和癌症疫苗等技术,但传统疗法因缺乏肿瘤特异性靶点,常导致脱靶效应或免疫耐受。新抗原作为肿瘤细胞特有的突变或修饰肽段,能通过人类白细胞抗原(HLA)呈递给T细胞,激活肿瘤特异性免疫反应,成为免疫治疗的理想靶点。随着高通量测序(如全外显子测序WES、RNA测序RNA-seq)、质谱(免疫肽组学)和人工智能(AI)的发展,新抗原预测算法不断优化,但仍面临算法准确性不足、泛化能力有限、免疫原性验证方法单一等挑战。本文旨在综合综述新抗原的来源分类、预测计算策略、临床应用现状及未来研究方向,为新抗原基免疫治疗的发展提供从基础到临床的完整参考。
2. 文献综述解析
本文作为系统性综述,以“新抗原来源-预测流程-临床应用-挑战机遇”为核心逻辑,梳理了新抗原从发现到临床应用的全链条研究进展,重点总结了新抗原预测算法的技术迭代、临床应用的成功案例,以及当前领域面临的关键问题。
现有研究的关键结论可分为四部分:新抗原来源包括体细胞突变(单核苷酸变异SNV、插入缺失INDEL、基因融合、结构变异)、RNA失调(可变剪接、RNA编辑、环状RNA circRNA)和蛋白修饰(蛋白酶体剪接肽、翻译后修饰PTM);预测流程涵盖HLA分型(如ArcasHLA用于RNA-seq数据、OptiType专注HLA-I分型)、HLA-肽结合预测(如NetMHCpan整合质谱数据、MHCflurry采用深度学习)、T细胞受体(TCR)-HLA-肽结合预测(如DeepTCR用深度神经网络、NetTCR-2.0整合TCRα/β链);临床应用中,新抗原疫苗(如mRNA-4157、Cevumeran)、ACT(TCR-T细胞疗法)、双特异性抗体已进入临床试验,显示出肿瘤特异性疗效;局限性包括预测模型泛化性差、免疫原性验证困难、共享新抗原鉴定不足。
本文的创新价值在于:相较于现有研究多聚焦于新抗原预测的单一环节(如HLA结合)或临床应用的单一方向(如疫苗),本文全面整合了新抗原的来源多样性、预测流程的技术细节、临床应用的多模态策略,同时总结了当前领域的挑战(如多组学数据整合、算法泛化能力、验证方法多样化),为新抗原研究提供了完整视角。
3. 研究思路总结与详细解析
本文作为综述性研究,无独立实验设计,而是以“分类总结+技术解析”的思路,系统梳理新抗原研究的核心环节:
3.1 新抗原来源分类与特征
综述目的:系统梳理新抗原的来源类型及免疫原性特征。
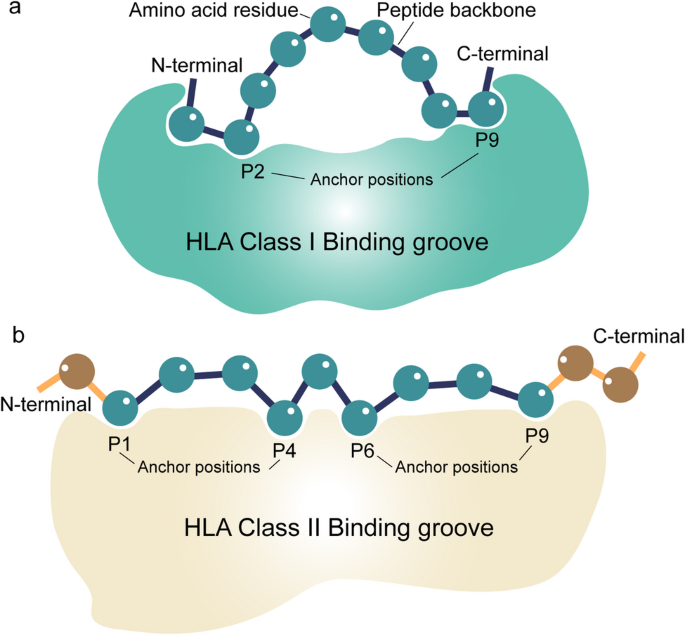
方法细节:总结现有研究中基于基因组、转录组、蛋白组数据的新抗原来源分析,包括体细胞突变(SNV、INDEL、融合、结构变异)、RNA失调(剪接、编辑、circRNA)、蛋白修饰(剪接肽、PTM)。
结果解读:体细胞突变是新抗原的主要来源,其中INDEL导致的移码肽因氨基酸序列变化大,具有更高免疫原性;RNA剪接和circRNA衍生的新抗原更易成为共享抗原(如MSI-H肿瘤的INDEL突变会产生泛患者新抗原);蛋白PTM(如磷酸化、瓜氨酸化)能产生新的T细胞表位。例如,circRNA衍生的新抗原在黑色素瘤、肺癌中被验证具有免疫原性,而MSI-H结直肠癌的INDEL突变会产生共享新抗原。
产品关联:文献未提及具体实验产品,领域常规使用高通量测序(WES、RNA-seq)、质谱(免疫肽组学)等技术。

3.2 新抗原预测流程与工具
综述目的:总结新抗原预测的关键环节及技术进展。
方法细节:按HLA分型、HLA-肽结合预测、TCR-pHLA结合预测三个环节,综述各环节的工具及算法:
- HLA分型:ArcasHLA利用RNA-seq数据提高分型准确性,OptiType专注HLA-I分型且性能优异;
- HLA-肽结合预测:NetMHCpan整合质谱洗脱肽数据提升准确性,MHCflurry采用深度学习模型优化预测;
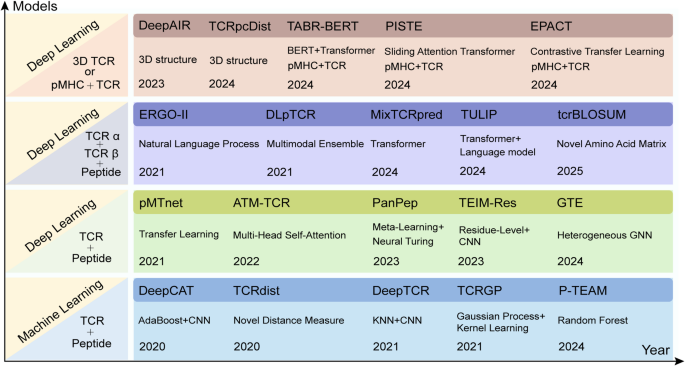
- TCR-pHLA结合预测:DeepTCR用深度神经网络处理TCR序列,NetTCR-2.0整合TCRα/β链信息提高泛化性。
结果解读:HLA分型的准确性直接影响后续预测,RNA-seq数据比DNA-seq更能反映HLA的表达水平;HLA结合预测中,深度学习算法比传统机器学习具有更高准确性;TCR-pHLA结合预测需整合TCR、肽和HLA信息,以解决未知抗原的预测问题。例如,NetMHCpan-4.1通过整合质谱数据,将HLA-I结合预测的AUC值提升至0.9以上;NetTCR-2.0通过双链TCR输入,将TCR-pHLA结合预测的F1-score提高20%。
产品关联:文献未提及具体实验产品,领域常规使用免疫信息学工具(如IEDB、CEDAR数据库)、深度学习框架(如TensorFlow、PyTorch)等。

3.3 新抗原临床应用策略
综述目的:总结新抗原在免疫治疗中的临床应用进展。
方法细节:按癌症疫苗、ACT、双特异性抗体三个方向,综述临床研究案例:
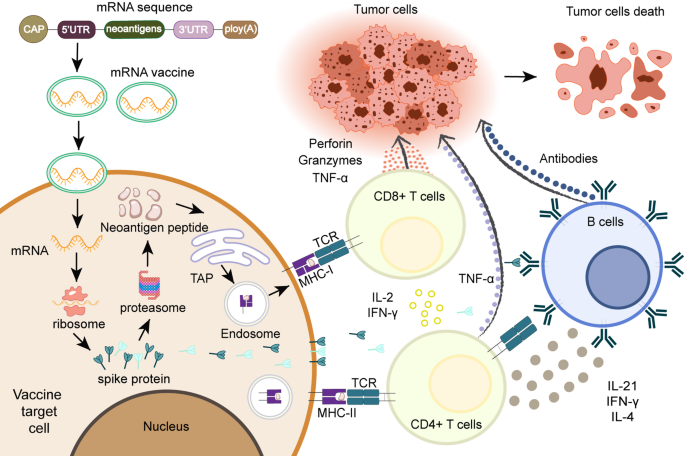
- 癌症疫苗:mRNA-4157是个性化新抗原疫苗,联合pembrolizumab治疗黑色素瘤;Cevumeran是泛癌种mRNA疫苗,用于胰腺癌治疗;
- ACT:TCR-T细胞疗法靶向SYT-SSX融合新抗原治疗滑膜肉瘤,CAR-T疗法靶向新抗原但仍需解决实体瘤穿透问题;
- 双特异性抗体:靶向NPM1/HLA0201复合物的双特异性抗体,用于急性髓系白血病(AML)治疗。
结果解读:新抗原疫苗在黑色素瘤、胰腺癌中显示出免疫激活和生存获益,如mRNA-4157联合治疗降低了65%的远处转移或死亡风险(n=157,P<0.001);TCR-T疗法在实体瘤中比CAR-T更具优势,但需解决靶点特异性问题;双特异性抗体能桥接T细胞和肿瘤细胞,增强免疫效应。例如,Cevumeran疫苗在胰腺癌患者中激活了71%的CD4+/CD8+ T细胞反应(n=28)。
产品关联:文献未提及具体实验产品,领域常规使用mRNA疫苗平台(如Moderna、BioNTech)、CAR-T/TCR-T制备系统(如Miltenyi Biotec细胞分选仪)等。

4. Biomarker研究及发现成果解析
核心信息段
本文中,新抗原作为肿瘤特异性Biomarker,其类型涵盖体细胞突变衍生、RNA失调衍生和蛋白修饰衍生的肽段,筛选与验证依赖“组学数据筛选-算法预测-实验验证”的逻辑链条,核心成果在于明确了新抗原作为Biomarker的临床价值及应用潜力。
Biomarker定位
新抗原属于肿瘤特异性Biomarker,类型包括:
1. 体细胞突变衍生:如SNV导致的氨基酸替换肽(如KRAS G12D突变肽);
2. RNA失调衍生:如可变剪接产生的新外显子连接肽、circRNA衍生肽(如circFAM53B衍生肽);
3. 蛋白修饰衍生:如蛋白酶体剪接肽、PTM修饰肽(如磷酸化的CDC25B肽)。
筛选逻辑为:通过WES/RNA-seq获取肿瘤突变或转录组数据,结合HLA分型预测可能的结合肽,再通过免疫肽组学(质谱)或TCR测序验证其免疫原性。
研究过程详述
新抗原的来源主要为肿瘤组织的基因组、转录组或蛋白组数据:
- 来源获取:通过WES检测SNV/INDEL,RNA-seq检测可变剪接事件,免疫肽组学质谱鉴定HLA结合肽;
- 验证方法:ELISpot检测T细胞应答(如mRNA-4157疫苗的临床研究中,通过ELISpot验证新抗原特异性T细胞增殖)、MHC四聚体分选抗原特异性T细胞(如分选CD8+ T细胞验证circRNA衍生肽的免疫原性)、动物模型评估疫苗疗效(如小鼠模型中验证新抗原疫苗的肿瘤抑制率)。
核心成果提炼
新抗原作为Biomarker,具有肿瘤特异性和免疫原性,能预测免疫治疗的疗效:
1. 共享新抗原:MSI-H肿瘤的INDEL突变会产生泛患者新抗原,可作为泛癌种Biomarker(如结直肠癌、胃癌的MSI-H新抗原);
2. 个性化新抗原:通过WES筛选患者的SNV衍生新抗原,指导个性化疫苗设计(如mRNA-4157疫苗为每位患者设计10-30个新抗原);
3. 临床疗效:mRNA-4157联合pembrolizumab治疗黑色素瘤,降低了65%的远处转移或死亡风险(n=157,P<0.001);Cevumeran疫苗在胰腺癌患者中激活了71%的CD4+/CD8+ T细胞反应(n=28)。
创新性在于,本文总结了不同来源新抗原的Biomarker特征,以及其在个性化免疫治疗(如mRNA-4157)和共享免疫治疗(如MSI-H新抗原疫苗)中的应用,为新抗原的临床转化提供了参考。