《肝细胞癌系统治疗的最新进展》-文献解析
1. 领域背景与文献引入
文献英文标题:Recent advances in systemic therapy for hepatocellular carcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:肝细胞癌系统治疗。
肝细胞癌(HCC)是全球最常见且致命的恶性肿瘤之一。2020年全球肝癌发病率居所有癌症第六位,死亡率居第三位,约90.5万新发病例和83万死亡病例,其中HCC占原发性肝癌的75%-85%。HCC通常确诊时已达晚期,既往治疗选择有限——直到2007年索拉非尼(sorafenib)获批为首个晚期HCC系统治疗药物,此后十余年索拉非尼一直是唯一有效选择。但索拉非尼存在耐药(原发性或获得性)、疗效局限(中位OS约1年)等问题,亟需更有效的治疗策略。近年来,分子靶向治疗(如仑伐替尼、瑞戈非尼)和免疫治疗(如PD-1抑制剂、联合治疗)的快速发展改变了HCC治疗格局,但仍需系统总结现有进展,明确各治疗策略的疗效、机制及未来方向。本文旨在整合肝细胞癌系统治疗的最新研究,涵盖已批准药物、在研疗法及生物标志物,为临床决策和研究提供参考。
2. 文献综述解析
作者以“治疗类型”为核心分类维度,将现有研究分为分子靶向治疗、免疫单药治疗、联合治疗及新型疗法四大类,系统评述各策略的疗效与局限。
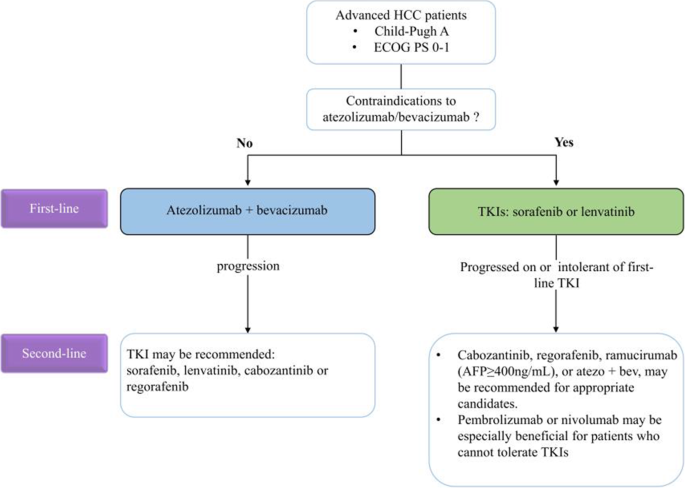
现有研究关键结论:分子靶向治疗中,索拉非尼是首个延长OS的药物,但耐药常见;仑伐替尼非劣效于索拉非尼且PFS更长;瑞戈非尼、卡博替尼、雷莫芦单抗作为二线治疗可延长OS。免疫单药治疗中,纳武利尤单抗(nivolumab)、帕博利珠单抗(pembrolizumab)的ORR约20%,但响应率有限。联合治疗中,纳武利尤单抗+伊匹木单抗(ipilimumab)的ORR达32%,阿替利珠单抗(atezolizumab)+贝伐珠单抗(bevacizumab)的mOS长达19.2个月,疗效显著优于单药。新型疗法(ADC、CAR-T、BiTE)尚处于早期阶段,但临床前研究显示潜在价值。
现有研究局限性:单药疗效有限(如索拉非尼的中位OS仅10.7个月),联合治疗的长期安全性待验证,缺乏广泛认可的疗效预测生物标志物。
本文创新价值:首次系统整合分子靶向、免疫治疗及新型疗法的最新进展,涵盖已批准和在研药物,突出联合治疗(如免疫+靶向)和生物标志物(如AFP、FGF19)的重要性,为HCC系统治疗提供全面的参考框架,填补了“多治疗策略整合分析”的研究空白。
3. 研究思路总结与详细解析
整体框架概括:研究目标是总结肝细胞癌系统治疗的最新进展;核心科学问题是“肝细胞癌系统治疗的现状、疗效及未来方向”;技术路线为“回顾关键临床研究→分析疗效数据与机制→总结新型疗法进展”,形成“现状-疗效-未来”的闭环逻辑。
3.1 分子靶向治疗进展分析
实验目的:解析已批准分子靶向药物的疗效及作用机制。
方法细节:回顾5项关键phase III试验(索拉非尼的SHARP、仑伐替尼的REFLECT、瑞戈非尼的RESORCE、卡博替尼的CELESTIAL、雷莫芦单抗的REACH-2),分析各药物的靶点(如索拉非尼抑制VEGFR、PDGFR、Raf通路;仑伐替尼抑制VEGFR、FGFR通路)。
结果解读:索拉非尼SHARP试验中,治疗组OS 10.7个月 vs 安慰剂组7.9个月(HR=0.69,p<0.0001),PFS 5.5 vs 2.8个月(p<0.001);仑伐替尼REFLECT试验中,OS非劣效(13.6 vs 12.3个月,HR=0.92),PFS 7.3 vs 3.6个月(HR=0.65,p<0.0001);瑞戈非尼RESORCE试验中,OS 10.6 vs 7.8个月(HR=0.63,p<0.0001),PFS 3.1 vs 1.5个月;卡博替尼CELESTIAL试验中,OS 10.2 vs 8.0个月(HR=0.76,p=0.005);雷莫芦单抗REACH-2试验中,AFP≥400 ng/mL患者OS 8.5 vs 7.3个月(HR=0.71,p=0.0199)。
产品关联:文献未提及具体实验产品,领域常规使用酪氨酸激酶抑制剂(如索拉非尼、仑伐替尼)及疗效评估的影像学试剂(如增强CT造影剂)。
3.2 免疫治疗进展分析
实验目的:评估免疫单药及联合治疗的疗效。
方法细节:回顾4项关键研究(纳武利尤单抗的CheckMate 040、帕博利珠单抗的KEYNOTE-224、纳武利尤单抗+伊匹木单抗的CheckMate 040队列4、阿替利珠单抗+贝伐珠单抗的IMbrave 150),分析免疫治疗的机制(如PD-1抑制剂恢复T细胞功能,CTLA-4抑制剂增强T细胞活化,靶向+免疫协同调控肿瘤微环境)。
结果解读:纳武利尤单抗CheckMate 040中,ORR 20%,中位响应持续时间9.9个月;帕博利珠单抗KEYNOTE-224中,ORR 17%,mOS 12.9个月;纳武利尤单抗+伊匹木单抗CheckMate 040队列4中,ORR 32%,mOS 22.2个月;阿替利珠单抗+贝伐珠单抗IMbrave 150中,mOS 19.2 vs 13.4个月(HR=0.66,p=0.0009),ORR 29.8% vs 11.3%。
产品关联:文献未提及具体实验产品,领域常规使用免疫检查点抑制剂(如纳武利尤单抗、帕博利珠单抗)及PD-L1检测抗体(如Dako的22C3)。
3.3 新型疗法进展分析
实验目的:探索ADC、CAR-T、BiTE等新型疗法的潜力。
方法细节:回顾GPC3-ADC、GPC3-CAR-T、CLDN6-ADC、GPC3/CD3 BiTE的临床前及早期临床研究,分析其机制(如ADC通过抗体靶向肿瘤抗原释放细胞毒素;CAR-T通过基因工程T细胞识别GPC3;BiTE通过双特异性抗体连接T细胞与肿瘤细胞)。
结果解读:GPC3-ADC临床前研究显示对GPC3+ HCC细胞有细胞毒性;GPC3-CAR-T phase I试验中,13例患者2例部分响应,mOS 278天;CLDN6-ADC preclinical研究抑制HCC细胞增殖;GPC3/CD3 BiTE phase I试验尚未公布结果。
产品关联:文献未提及具体实验产品,领域常规使用基因工程试剂(如CAR-T的慢病毒载体)、抗体药物偶联物(如GPC3-ADC)及免疫组化抗体(如GPC3抗体)。
4. Biomarker研究及发现成果解析
Biomarker定位:涉及3类Biomarker——甲胎蛋白(AFP,循环血清标志物)、成纤维细胞生长因子19(FGF19,肿瘤组织/血清标志物)、糖基化磷脂酰肌醇锚定蛋白3(GPC3,肿瘤细胞表面标志物)。筛选/验证逻辑:AFP通过REACH试验亚组分析发现,REACH-2验证;FGF19通过FGFR4抑制剂phase I试验验证;GPC3通过CAR-T preclinical及phase I试验验证。
研究过程详述:
- AFP:来源为临床血清样本,验证方法为化学发光免疫分析法。REACH-2试验中,AFP≥400 ng/mL患者接受雷莫芦单抗治疗的mOS为8.5个月(安慰剂组7.3个月,HR=0.71,95% CI 0.53-0.95,p=0.0199),显示AFP是雷莫芦单抗的疗效预测因子。
- FGF19:来源为肿瘤组织或血清,验证方法为实时荧光定量PCR。FGFR4抑制剂fisogatinib的phase I试验中,FGF19阳性患者ORR 17%(11/66),阴性患者0%(p<0.05),提示FGF19是FGFR4抑制剂的生物标志物。
- GPC3:来源为肿瘤组织,验证方法为免疫组化。GPC3-CAR-T phase I试验中,GPC3+患者ORR 15%(2/13),mOS 278天,表明GPC3是CAR-T的有效靶点。
核心成果提炼:
- AFP作为雷莫芦单抗的疗效 Biomarker,显著延长AFP≥400 ng/mL患者的OS(HR=0.71,p=0.0199),是首个获批的HCC系统治疗生物标志物。
- FGF19作为FGFR4抑制剂的 Biomarker,阳性患者ORR显著高于阴性患者(17% vs 0%),为FGFR4抑制剂的精准应用提供依据。
- GPC3作为CAR-T的靶点,在GPC3+患者中显示初步抗肿瘤活性(2/13部分响应),是新型细胞治疗的潜力 Biomarker。
这些成果填补了HCC系统治疗“缺乏疗效预测生物标志物”的空白,为精准医疗奠定基础。
(注:文中图片已按原文位置插入,对应Fig1-5的URL分别为:
Fig1:

Fig2:
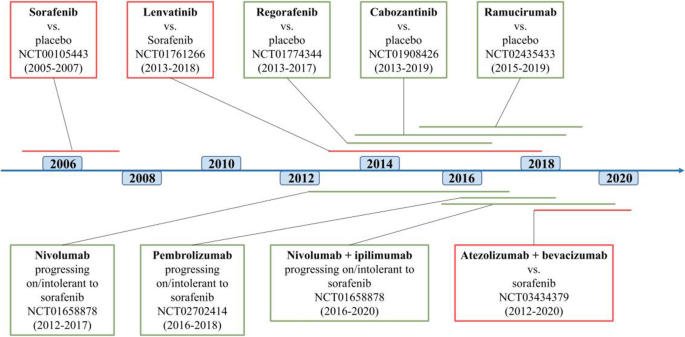
Fig3:
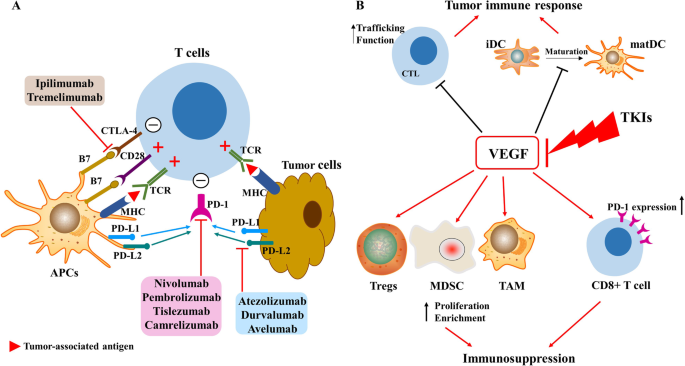
Fig4:

Fig5:
)
