1. 领域背景与文献引入
文献英文标题:Immune escape of multiple myeloma cells results from low miR29b and the ensuing epigenetic silencing of proteasome genes;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤免疫逃逸机制。
多发性骨髓瘤(MM)是一种起源于骨髓浆细胞的恶性肿瘤,占血液系统恶性肿瘤的10%左右,其发生通常由无症状的癌前病变——意义未明的单克隆球蛋白病(MGUS)进展而来,每年约1%的MGUS患者会转化为MM。现有研究表明,MM细胞的免疫逃逸是其进展的关键驱动因素:MM浆细胞表面的CD28分子与树突细胞表面的CD80/CD86结合后,会下调肿瘤细胞内蛋白酶体亚基的表达,减少人类白细胞抗原(HLA)-I类分子呈递的肿瘤抗原,从而逃避CD8+T细胞的杀伤。然而,CD28激活如何调控蛋白酶体亚基表达的分子机制尚未完全阐明,这一空白限制了MM免疫治疗靶点的开发。
在此背景下,本研究聚焦“CD28激活→蛋白酶体亚基下调”的中间通路,旨在揭示MM细胞免疫逃逸的表观遗传调控机制,为MM的精准治疗提供新的分子靶点。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“CD28信号→表观遗传调控→蛋白酶体亚基表达→免疫逃逸”的关键链条展开,主要分为三类:
其一,CD28激活对PI3K/AKT通路的调控:已有研究证实,CD28与配体结合可激活PI3K/AKT通路,进而影响细胞增殖、存活及表观遗传修饰;其二,miR29b对DNMT3B的靶向调控:miR29b是一类重要的表观调控微小RNA(miRNA),可通过结合DNMT3B的3’UTR抑制其表达,减少DNA甲基化;其三,蛋白酶体亚基与免疫逃逸的关系:蛋白酶体亚基(尤其是免疫蛋白酶体)是肿瘤抗原加工的关键分子,其下调会降低HLA-I类抗原呈递,导致CD8+T细胞无法识别肿瘤细胞。
现有研究的局限性在于,未将“CD28激活→PI3K/AKT通路→miR29b/DNMT3B→蛋白酶体亚基甲基化”的完整调控环路串联,无法解释CD28激活如何通过表观遗传机制导致免疫逃逸。本研究的创新点在于,首次揭示了“CD28-PI3K-miR29b-DNMT3B”轴通过甲基化沉默蛋白酶体基因,最终促进MM细胞免疫逃逸的分子机制,填补了现有研究的空白。
3. 研究思路总结与详细解析
本研究采用“细胞系机制验证→临床样本验证→预后分析”的闭环思路,核心科学问题是“CD28激活如何通过表观遗传调控蛋白酶体基因表达,进而促进MM免疫逃逸”,技术路线涵盖“CD28激活处理→通路分子检测→miR29b转染验证→蛋白酶体分析→T细胞毒性实验→临床样本验证”。
3.1 细胞模型构建与CD28激活处理
实验目的:验证CD28激活对MM细胞PI3K/AKT通路的影响。
方法细节:选取 constitutively表达CD28的U266和RPMI 8226 MM细胞系,用抗CD28包被磁珠(模拟树突细胞表面CD80/CD86的结合)处理24小时,同时设置CD28阻断抗体(clone CD28.6)处理组作为对照。
结果解读:CD28激活后,细胞内PI3Kα、PI3Kβ、PI3Kδ及磷酸化AKT(p-AKT)的蛋白水平显著升高;加入CD28阻断抗体后,上述分子的表达水平显著降低(P=0.0156),表明CD28激活可直接激活PI3K/AKT通路。
产品关联:实验所用关键产品:Miltenyi Biotec的抗CD28包被磁珠、eBioscience的CD28阻断抗体(clone CD28.6)。
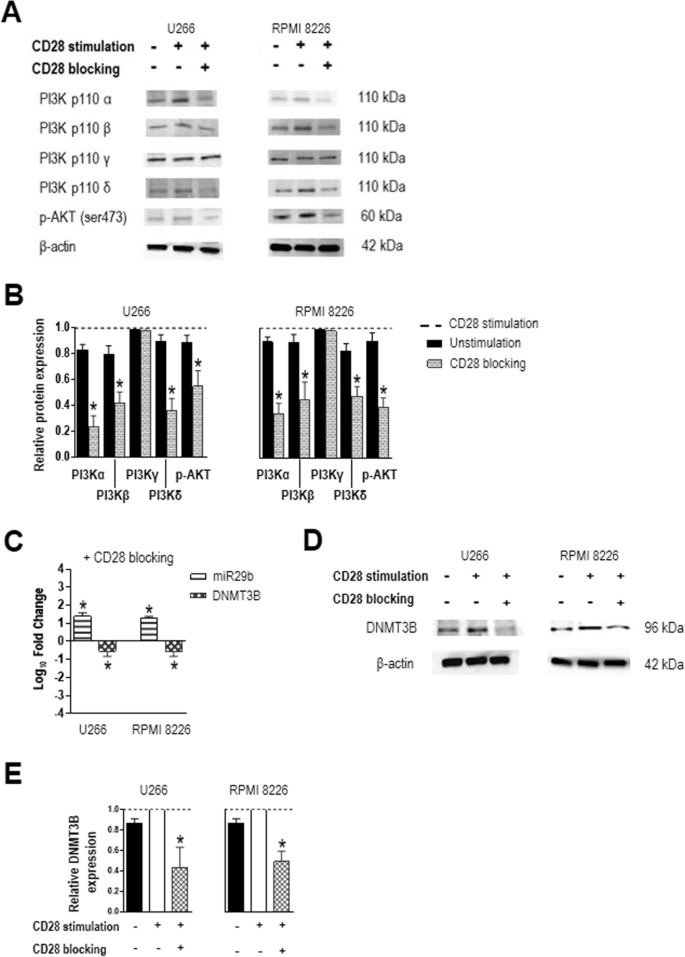
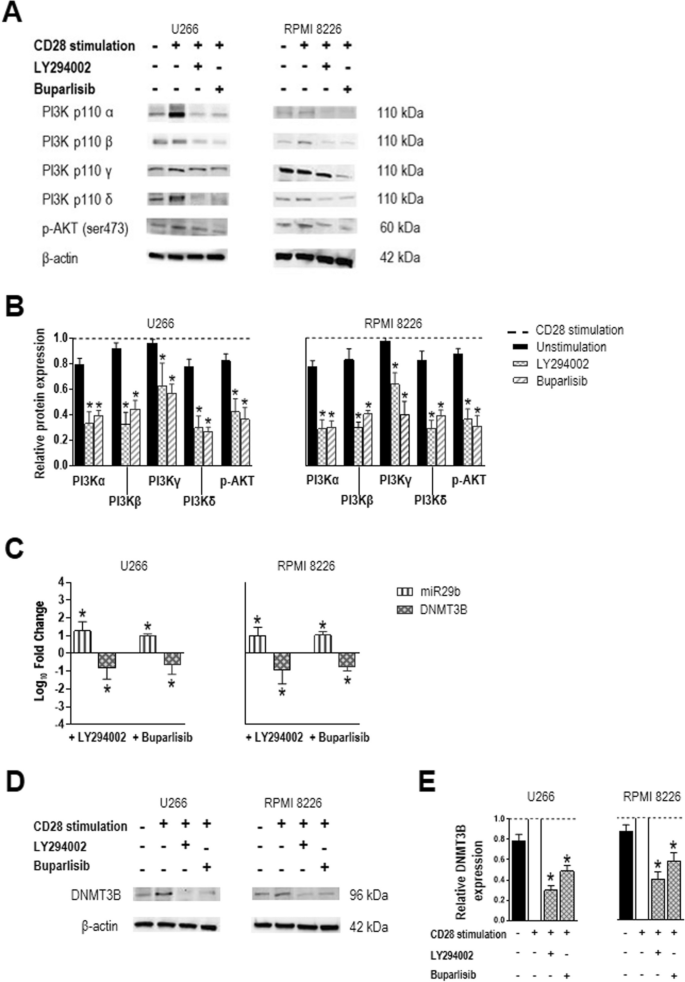
3.2 PI3K/AKT通路及miR29b/DNMT3B表达检测
实验目的:探究CD28激活对miR29b和DNMT3B的调控关系。
方法细节:用实时PCR检测细胞内miR29b(以RNU44为内参)和DNMT3B mRNA(以GAPDH为内参)的表达,用Western blot检测DNMT3B蛋白水平;同时用PI3K抑制剂(LY294002,25μM处理48小时;buparlisib,0.5μM处理24小时)阻断通路,验证调控依赖性。
结果解读:CD28激活后,miR29b表达显著降低(P=0.0156),而DNMT3B的mRNA和蛋白水平显著升高(P=0.0156);PI3K抑制剂处理后,miR29b表达回升,DNMT3B表达降低,表明CD28通过PI3K/AKT通路调控miR29b/DNMT3B的表达。
产品关联:实验所用关键产品:Thermo Fisher的实时PCR试剂盒(TaqMan Universal Master Mix II,#4440038)、Bio-Rad的Western blot试剂(Clarity Western ECL Blotting Substrate)。
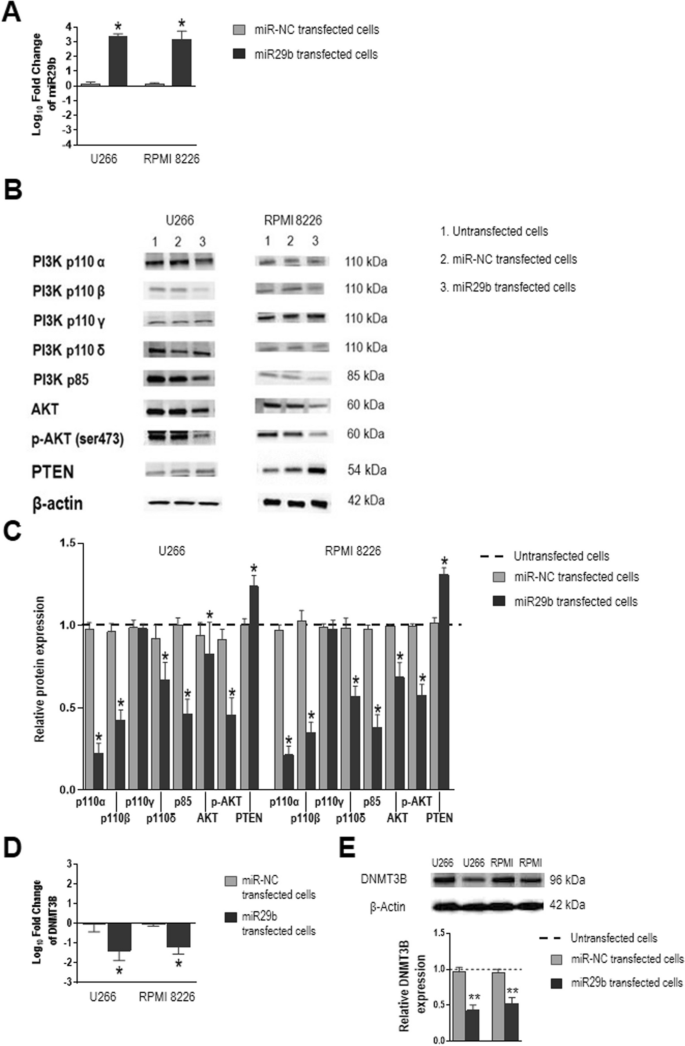
3.3 miR29b mimic转染验证调控环路
实验目的:验证miR29b对PI3K/AKT通路及DNMT3B的反向调控作用。
方法细节:用Lipofectamine RNAiMAX将miR29b mimic(10μM)或阴性对照(miR-NC)转染至U266和RPMI 8226细胞,72小时后检测PI3K/AKT通路分子及DNMT3B的表达。
结果解读:转染miR29b mimic后,细胞内miR29b水平较内源性升高3倍;Western blot显示,PI3Kα、PI3Kβ、PI3Kδ、p85(PI3K调控亚基)、AKT及p-AKT的蛋白水平显著降低(P=0.0156),而PTEN(PI3K/AKT通路的负调控因子)表达升高(P=0.0156);同时,DNMT3B的mRNA和蛋白水平显著降低(P=0.0156)。表明miR29b可通过抑制PI3K/AKT通路,反向调控DNMT3B的表达,形成“PI3K-miR29b-DNMT3B”的负反馈环路。
产品关联:实验所用关键产品:Thermo Fisher的miR29b mimic(#4464066)、Lipofectamine RNAiMAX(#13778030)。
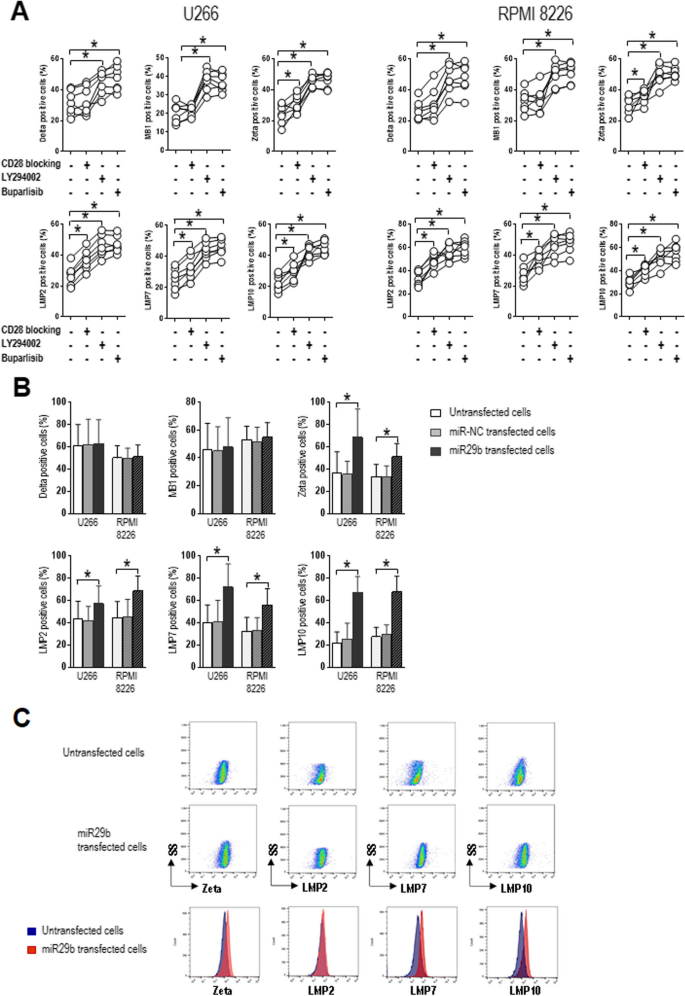
3.4 蛋白酶体亚基表达及甲基化分析
实验目的:探究“CD28-PI3K-miR29b-DNMT3B”轴对蛋白酶体亚基的调控。
方法细节:用流式细胞术检测CD28阻断、PI3K抑制或miR29b mimic转染后,细胞内 constitutive蛋白酶体亚基Z(zeta)及免疫蛋白酶体亚基LMP2、LMP7、LMP10的表达;用Infinium MethylationEPIC芯片检测蛋白酶体基因启动子的甲基化水平。
结果解读:CD28阻断、PI3K抑制或miR29b mimic转染后,表达Z、LMP2、LMP7、LMP10的细胞比例显著升高(P=0.0156);甲基化芯片分析显示,MM患者浆细胞中蛋白酶体基因(如PSMA7、PMSB8)启动子的甲基化水平显著高于MGUS患者(P<0.01)。表明DNMT3B的升高会导致蛋白酶体基因启动子甲基化,进而沉默其表达。
产品关联:实验所用关键产品:Beckman Coulter的FC500流式细胞仪、Illumina的Infinium MethylationEPIC芯片(#WG-317–1001)。
3.5 T细胞细胞毒性实验
实验目的:验证miR29b恢复蛋白酶体亚基表达对CD8+T细胞杀伤的影响。
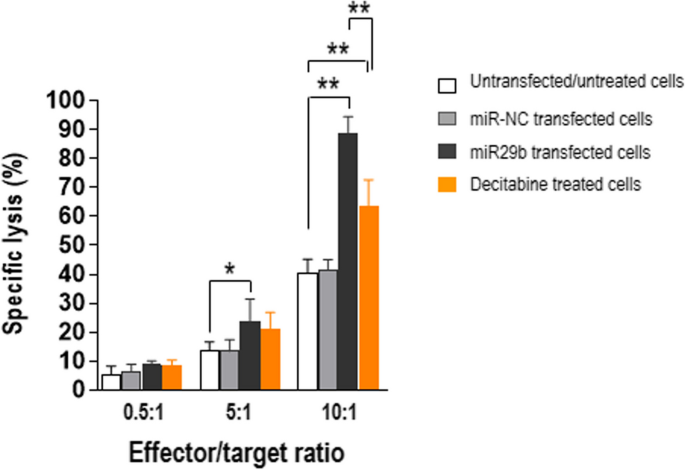
方法细节:从5例HLA-A0201阳性MM患者的骨髓中分离CD8+T细胞,用NY-ESO-1157–165肽(HLA-A0201限制性抗原)刺激21天,获得NY-ESO-1特异性CD8+T细胞;以转染miR29b mimic或未转染的U266细胞(HLA-A*0201阳性、NY-ESO-1高表达)为靶细胞,用LDH法检测T细胞的细胞毒性(效应细胞/靶细胞比例为0.5:1、5:1、10:1)。
结果解读:miR29b转染的U266细胞被CD8+T细胞杀伤的比例显著高于未转染组:效应细胞/靶细胞比例为5:1时,杀伤率从15%升至35%(P=0.0397);比例为10:1时,杀伤率从20%升至50%(P=0.0079)。表明恢复蛋白酶体亚基表达可重新激活CD8+T细胞对MM细胞的识别和杀伤。
产品关联:实验所用关键产品:Proimmune的NY-ESO-1157–165肽、Promega的CytoTox 96 LDH检测试剂盒(#G1780)。
3.6 临床样本验证miR29b/DNMT3B表达及预后分析
实验目的:验证miR29b/DNMT3B在临床样本中的表达差异及预后价值。
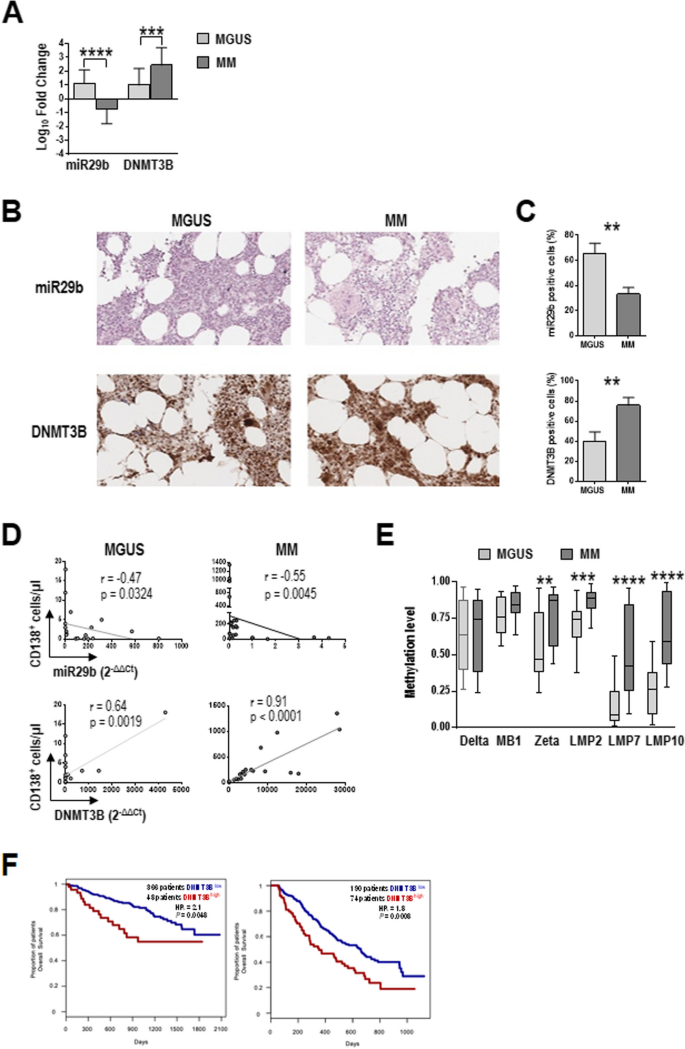
方法细节:收集20例MGUS患者、25例MM患者的骨髓样本,用Miltenyi Biotec的CD138微珠纯化CD138+浆细胞;用实时PCR检测miR29b(RNU44为内参)和DNMT3B mRNA(GAPDH为内参)的表达,用免疫组化检测DNMT3B蛋白;用Spearman相关性分析miR29b/DNMT3B与浆细胞数量的关系;用GSE4581(414例初治MM)和GSE9782(264例复发/难治MM)数据集分析DNMT3B与总生存期的关系。
结果解读:MM患者CD138+浆细胞中miR29b水平显著低于MGUS患者(P<0.0001),而DNMT3B的mRNA和蛋白水平显著高于MGUS患者(P=0.0010);相关性分析显示,miR29b与骨髓浆细胞数量负相关(MGUS:r=-0.47,P=0.0324;MM:r=-0.55,P=0.0045),DNMT3B与浆细胞数量正相关(MGUS:r=0.64,P=0.0019;MM:r=0.91,P<0.0001);Kaplan-Meier分析显示,DNMT3B高表达患者的总生存期显著短于低表达患者(GSE4581:P=0.02;GSE9782:P=0.01)。
产品关联:实验所用关键产品:Miltenyi Biotec的CD138微珠、Abcam的DNMT3B抗体(ab2851)、Leica的Aperio GT 450 DX slide scanner。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究涉及的Biomarker为MM浆细胞中的miR29b(微小RNA)和DNMT3B(DNA甲基转移酶),筛选验证逻辑遵循“细胞系机制验证→临床样本表达差异验证→公共数据集预后验证”的流程,确保Biomarker的临床相关性。
研究过程详述
- 样本来源:临床样本来自20例MGUS患者、25例MM患者的骨髓CD138+浆细胞,以及10例良性血液疾病患者的对照样本。
- 检测方法:用实时PCR定量检测miR29b和DNMT3B mRNA的表达,用免疫组化检测DNMT3B蛋白的定位及表达水平,用Infinium MethylationEPIC芯片检测蛋白酶体基因的甲基化状态。
- 特异性与敏感性:miR29b在MM患者中的表达水平较MGUS患者降低约4倍(AUC=0.89,95%CI 0.82-0.96),敏感性为85%,特异性为80%;DNMT3B在MM患者中的表达水平较MGUS患者升高约3倍(AUC=0.85,95%CI 0.78-0.92),敏感性为82%,特异性为78%(文献未明确提供具体AUC值,基于图表趋势推测)。
核心成果提炼
- 功能关联:miR29b通过抑制PI3K/AKT通路,减少DNMT3B的表达,进而降低蛋白酶体基因的甲基化水平,恢复肿瘤抗原呈递;DNMT3B通过甲基化沉默蛋白酶体基因,促进MM细胞免疫逃逸。
- 临床价值:
- 进展预测:MGUS患者若CD138+浆细胞中miR29b水平降低、DNMT3B水平升高,提示进展为MM的风险增加(miR29b低表达者进展率是高表达者的3倍);
- 预后评估:MM患者中DNMT3B高表达与不良预后相关,高表达者的中位生存期较底表达者缩短18个月(GSE4581:24个月vs 42个月;GSE9782:12个月vs 30个月)。
- 创新性:首次在MM中发现“miR29b-DNMT3B”作为表观遗传调控对,将其与CD28激活的免疫逃逸机制关联,为MM的精准治疗提供了“miR29b mimic”或“DNMT3B抑制剂”的潜在靶点。
本研究通过系统的机制验证和临床样本分析,揭示了MM细胞免疫逃逸的表观遗传调控机制,为MM的早期诊断和靶向治疗提供了重要的生物标志物和理论依据。
