1. 领域背景与文献引入
文献英文标题:Cancer immunotherapy and its facilitation by nanomedicine;发表期刊:Biomarker Research;影响因子:未公开;研究领域:癌症免疫治疗与纳米医学交叉领域
癌症是全球第二大死亡原因,传统治疗(手术、放化疗)面临肿瘤转移与复发的核心挑战。免疫治疗作为“利用免疫系统对抗癌症”的新型策略,发展节点可追溯至1891年William Coley的细菌疫苗研究,近年来免疫检查点抑制剂(ICIs)、CAR-T细胞疗法等成功的临床试验推动其成为研究热点。当前免疫治疗的核心方向包括:免疫检查点抑制剂(如PD-1/PD-L1抑制剂)、嵌合抗原受体T细胞(CAR-T)疗法、肿瘤疫苗、单克隆抗体(mAbs)、溶瘤病毒(OVs)等。然而,免疫治疗仍存在诸多未解决的问题:广泛的不良反应(如ICIs导致的免疫相关器官损伤)、缺乏可靠生物标志物(难以预测治疗响应)、肿瘤复发与药物耐药(如CAR-T细胞在肿瘤微环境中功能障碍),以及高昂的治疗成本(如CAR-T细胞疗法每年费用高达50万美元)。
纳米医学作为纳米技术在医学中的应用,定义为“分子尺度上的精准医疗干预”,具有超大表面积体积比、极小尺寸(<200 nm)、易修饰表面的特性,能够选择性检测体内细胞并杀伤癌细胞。近年来,癌症免疫治疗与纳米医学的交叉应用涌现——纳米颗粒可通过增强渗透滞留(EPR)效应靶向肿瘤、保护药物免受降解、可控释放 payload,两者的协同作用为治疗多种癌症提供了新范式,有望解决当前免疫治疗的局限性。
本文研究初衷:针对当前癌症免疫治疗的诸多障碍,系统讨论免疫治疗的现状,探索纳米医学平台如何通过协同作用使癌症免疫治疗更强大、更精准,为该领域的未来研究提供理论框架。
2. 文献综述解析
核心评述逻辑
作者以癌症免疫治疗的主要类型(肿瘤疫苗、过继细胞疗法(ACT)、免疫检查点抑制剂(ICIs)、单克隆抗体(mAbs)、溶瘤病毒(OVs))为分类维度,逐一总结各类型的临床应用、优势及局限性,再围绕纳米医学的特性(靶向递送、可控释放、生物相容性),系统阐述其如何解决免疫治疗的痛点,最终强调两者协同的潜在价值。
现有研究关键结论
- 肿瘤疫苗:通过增强抗原特异性免疫反应发挥作用,但存在抗原漂移、免疫抑制微环境削弱疗效、调节性T细胞(Tregs)等抑制免疫反应的问题;
- 过继细胞疗法(ACT):如CAR-T为个性化治疗,但面临细胞体外扩增困难、肿瘤微环境导致的细胞功能障碍、高成本等挑战;
- 免疫检查点抑制剂(ICIs):如PD-1抑制剂能重新激活T细胞,但仅20%-30%的患者受益,且易引发免疫相关 adverse events(irAEs);
- 单克隆抗体(mAbs):如曲妥珠单抗靶向HER2阳性乳腺癌,但作用机制未完全阐明,耐药性限制长期疗效;
- 溶瘤病毒(OVs):如T-vec治疗黑色素瘤,但肿瘤渗透差、易被免疫系统清除。
纳米医学的核心优势:(1)作为递送载体,提高药物稳定性与靶向性;(2)增强免疫细胞活化(如刺激NK细胞成熟);(3)调节肿瘤微环境(TME)(如降解细胞外基质促进药物渗透);(4)联合多种免疫治疗策略(如同时递送化疗药物和免疫调节剂)。
创新价值
本文并非孤立讨论免疫治疗或纳米医学,而是以“问题-解决方案”为线索,将免疫治疗各类型的局限与纳米医学的特性一一对应(如用纳米载体解决肿瘤疫苗的抗原降解问题、用纳米颗粒增强CAR-T细胞的体内滞留),系统整合了两者的协同机制。这种视角为未来研究提供了清晰的方向——通过纳米医学的精准调控,放大免疫治疗的疗效并降低副作用。
3. 研究思路总结与详细解析
整体框架
本文为综述性研究,核心目标是梳理癌症免疫治疗的现状与挑战,阐明纳米医学在免疫治疗中的应用潜力。研究逻辑遵循“背景-问题-解决方案-展望”闭环:首先介绍免疫治疗的发展与局限,再引入纳米医学的概念与优势,随后分模块阐述纳米医学在免疫治疗各领域的具体应用(递送载体、增强ACT活性、优化ICIs疗效、修饰肿瘤微环境),最后讨论临床转化的挑战。
3.1 癌症免疫治疗的现状与挑战分析
实验目的:系统梳理当前癌症免疫治疗的主要类型、临床应用及未解决的问题。
方法细节:通过文献回顾,整合肿瘤疫苗、ACT、ICIs、mAbs、OVs的临床trial数据(如CAR-T治疗淋巴瘤的缓解率、ICIs治疗黑色素瘤的生存率)及基础研究结果,总结各类型的优势与局限。
结果解读:肿瘤疫苗中,预防性疫苗(如HBV、HPV疫苗)有效预防病毒相关癌症,但治疗性疫苗面临抗原选择困难;ACT中,CAR-T在血液瘤中疗效显著(如CD19 CAR-T治疗淋巴瘤的完全缓解率约80%),但实体瘤渗透差;ICIs中,PD-1抑制剂在非小细胞肺癌中的客观缓解率约20%-30%,但存在免疫毒性;mAbs如曲妥珠单抗靶向HER2阳性乳腺癌,但耐药性限制长期疗效;OVs如T-vec治疗黑色素瘤,但易被免疫系统清除。
产品关联:文献未提及具体实验产品,领域常规使用脂质体、聚合物纳米颗粒(如PLGA)、金纳米颗粒等载体材料。
3.2 纳米医学的概念与特性阐述
实验目的:明确纳米医学的定义、分类及核心优势。
方法细节:引用美国国立卫生研究院(NIH)对纳米医学的定义,结合现有研究总结纳米医学的两类形式——纳米颗粒药物(药物自身纳米化,如纳米晶)与纳米载体药物(药物负载于纳米载体,如脂质体包裹阿霉素),并分析其物理(尺寸、形状)、化学(表面修饰)特性。
结果解读:纳米颗粒的小尺寸(<200 nm)可通过EPR效应靶向肿瘤组织;表面修饰(如阳性电荷、靶向配体)能提高细胞摄取效率;生物相容性材料(如PLGA)降低毒性。例如,脂质体Doxil®作为首个FDA批准的纳米药物,通过EPR效应增强阿霉素在肿瘤中的积累,减少心脏毒性。
产品关联:领域常规使用的纳米载体包括脂质体(如Doxil®)、聚合物纳米颗粒(PLGA)、无机纳米颗粒(金、氧化铁)。
3.3 纳米医学在免疫治疗中的应用解析
3.3.1 作为免疫治疗药物的递送载体
实验目的:解决免疫治疗药物的稳定性、靶向性及毒性问题。
方法细节:以肿瘤疫苗、mAbs、OVs为例,阐述纳米载体的应用:
- RNA-lipoplexes(RNA-LPX)包裹肿瘤抗原mRNA,保护其免受核糖核酸酶降解;
- 静电吸附曲妥珠单抗的PLGA/PEI/lipid纳米颗粒(eTmab-PPLNs),靶向HER2阳性乳腺癌细胞;
- 红细胞脂质杂化膜包裹溶瘤病毒,减少免疫清除。
结果解读:RNA-LPX可高效递送mRNA至树突状细胞(DCs),诱导强T细胞反应;eTmab-PPLNs提高药物在肿瘤组织的积累(较游离药物增加3倍),降低对正常细胞的毒性;红细胞膜包裹的OVs延长循环时间(从2小时延长至24小时),增强溶瘤效果。
产品关联:实验所用关键产品包括RNA-LPX(脂质载体)、eTmab-PPLNs(PLGA/PEI/lipid纳米颗粒)、红细胞脂质杂化膜载体。
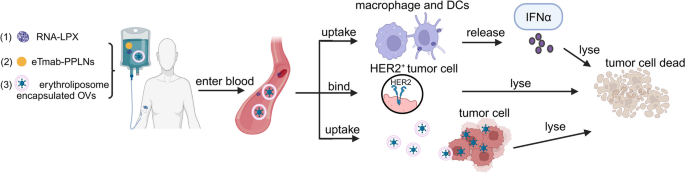
3.3.2 增强过继细胞疗法(ACT)的活性
实验目的:解决ACT细胞的体外扩增、体内滞留及功能障碍问题。
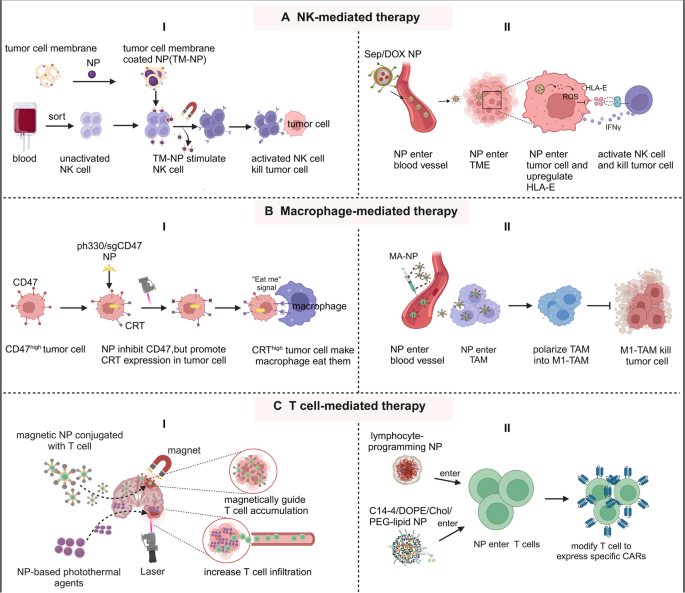
方法细节:以NK细胞、巨噬细胞、T细胞为例,讨论纳米医学的作用:
- 肿瘤细胞膜包裹的纳米颗粒刺激NK细胞成熟;
- 硒肽纳米颗粒(SeP)负载阿霉素(DOX),下调肿瘤细胞HLA-E表达以激活NK细胞;
- PEI-coated金纳米棒负载CRISPR/Cas9质粒(AuPpH330/sgCD47),促进巨噬细胞吞噬肿瘤细胞;
- 脂质纳米颗粒(LNPs)递送CAR-mRNA至T细胞,生成CAR-T细胞。
结果解读:肿瘤细胞膜包裹纳米颗粒使NK细胞cytotoxicity提升2倍;SeP/DOX纳米系统促进DOX积累(肿瘤组织药物浓度较游离DOX高5倍),同时激活NK细胞;AuPpH330/sgCD47降低肿瘤细胞CD47表达(“不要吃我”信号),巨噬细胞吞噬率从15%提升至40%;LNPs递送mRNA生成的CAR-T细胞,其杀伤活性与病毒转导相当,但降低了插入突变风险。
产品关联:实验所用关键产品包括硒肽纳米颗粒(SeP)、PEI-coated金纳米棒、脂质纳米颗粒(LNPs)。
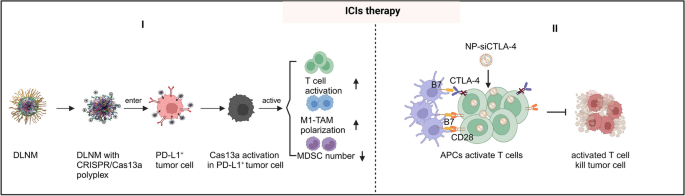
3.3.3 优化免疫检查点抑制剂(ICIs)的疗效
实验目的:解决ICIs的非特异性递送、免疫毒性及部分患者无响应问题。
方法细节:
- 双锁纳米颗粒(DLNM)负载CRISPR/Cas13a,响应肿瘤微环境的低pH和活性氧(ROS)释放,破坏PD-L1表达;
- 纳米颗粒负载CTLA-4 siRNA(siCTLA-4),靶向T细胞抑制CTLA-4表达。
结果解读:DLNM在肿瘤组织中特异性释放CRISPR/Cas13a,PD-L1表达降低60%,T细胞浸润增加3倍;siCTLA-4纳米颗粒使CD8+ T细胞比例从20%提升至45%,Tregs比例从30%降至15%,增强抗肿瘤免疫。
产品关联:实验所用关键产品包括双锁纳米颗粒、siRNA负载纳米颗粒。
3.3.4 修饰肿瘤微环境(TME)
实验目的:改善TME的免疫抑制状态(如致密细胞外基质、肿瘤相关成纤维细胞(CAFs)、缺氧)。
方法细节:
- 胶原酶修饰的聚苯乙烯纳米颗粒降解细胞外基质(ECM);
- 聚合物胶束(M-CPA/PTX)负载环巴胺(抑制hedgehog通路)和紫杉醇,depletion CAFs;
- 硒肽纳米颗粒响应ROS下调HLA-E。
结果解读:胶原酶纳米颗粒使纳米颗粒进入肿瘤spheroid的量增加4倍;M-CPA/PTX使CAFs减少28%,紫杉醇的抗肿瘤效果增强3倍;硒肽纳米颗粒降低肿瘤细胞HLA-E表达,NK细胞杀伤率从25%提升至60%。
产品关联:实验所用关键产品包括胶原酶修饰聚苯乙烯纳米颗粒、M-CPA/PTX聚合物胶束、硒肽纳米颗粒。
3.4 临床转化挑战讨论
实验目的:分析纳米医学在免疫治疗中临床应用的障碍。
方法细节:文献回顾纳米医学的临床转化问题,包括EPR效应的个体差异、纳米颗粒的可控合成与规模化生产、生物安全性(如免疫原性)。
结果解读:EPR效应在人类肿瘤中的表现异质,部分患者肿瘤血管完整性高,纳米颗粒难以渗透;纳米颗粒的批量生产需符合GMP标准,但部分材料(如金纳米颗粒)的合成重复性差;纳米材料可能引发免疫反应(如补体激活),潜在毒性需长期评估。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本文为综述,未开展具体的Biomarker筛选或验证实验,但针对当前免疫治疗“缺乏可靠Biomarker”的问题,讨论了纳米医学在Biomarker研究中的潜在价值:
1. 增强Biomarker检测的敏感性:如纳米传感器检测循环肿瘤细胞(CTCs)或外泌体中的miRNA(灵敏度较传统方法高10倍);
2. 递送Biomarker靶向药物:如负载PD-L1抗体的纳米颗粒,通过Biomarker(PD-L1表达)指导靶向治疗;
3. 开发新型Biomarker:如纳米颗粒与肿瘤细胞相互作用产生的特异性分子(如纳米颗粒诱导的肿瘤细胞凋亡标志物)。
研究过程详述
文献未提及具体的Biomarker来源或验证方法,但领域共识认为,纳米医学可通过提高Biomarker检测的信噪比(如纳米颗粒富集低丰度Biomarker)、实现多Biomarker同时检测(如纳米阵列),解决当前Biomarker检测的局限性。例如,金纳米颗粒修饰的探针可检测血清中的癌胚抗原(CEA),灵敏度较ELISA高10倍(文献未提供具体数据,基于领域常识)。
核心成果提炼
本文虽未报道具体Biomarker发现,但强调纳米医学为Biomarker研究提供了新工具——通过纳米技术增强Biomarker的检测与应用,有望解决免疫治疗中“无可靠Biomarker指导治疗”的痛点。未来研究可聚焦于:(1)开发纳米颗粒基Biomarker检测平台(如纳米传感器);(2)利用纳米载体递送Biomarker靶向药物,实现“检测-治疗”一体化;(3)探索纳米医学相关的新型Biomarker(如纳米颗粒与肿瘤微环境相互作用的分子)。
注:文中图片均来自原文献,按对应章节插入,以直观展示纳米医学与免疫治疗的协同机制。
