1. 领域背景与文献引入
文献英文标题:Development of acoustically isolated extracellular plasma vesicles for biomarker discovery in allogeneic hematopoietic stem cell transplantation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:异基因造血干细胞移植(allo-HSCT)相关生物标志物研究。
异基因造血干细胞移植是治疗高危/复发血液恶性肿瘤的关键手段,但感染和移植物抗宿主病(GvHD)是导致患者死亡与发病的主要并发症。早期诊断这些并发症对及时干预至关重要,然而现有生物标志物(如肿瘤坏死因子受体1、白细胞介素2受体α等)准确性有限,无法可靠预测并发症的发生。细胞外囊泡(EVs)是细胞分泌的磷脂膜囊泡,包裹疾病相关的蛋白质、DNA及RNA,被视为潜在的非侵入性生物标志物。但传统EV分离方法(如超离心)存在操作繁琐、需大样本量、重复性差等缺陷,限制了其临床应用。因此,开发适用于小样本量的自动化EV分离技术,并验证其在allo-HSCT并发症生物标志物发现中的可行性,成为该领域未解决的核心问题。本研究旨在利用新型声学捕获技术分离血浆EVs,探索其作为allo-HSCT并发症生物标志物的潜力,为早期诊断提供新策略。
2. 文献综述解析
文献综述围绕“EVs作为生物标志物的潜力→传统EV分离方法的缺陷→声学捕获技术的优势”展开评述。现有研究的关键结论包括:EVs的分子组成反映来源细胞的病理状态,是潜在生物标志物;超离心等传统方法耗时、需大样本量,且不同实验室结果重复性差;声学捕获技术是自动化、无标记的微流控技术,可从少量样本中富集EVs,具有临床转化潜力。现有研究的局限性在于:传统方法无法满足临床小样本量需求,声学捕获技术在allo-HSCT中的应用未被验证。本研究的创新价值在于首次将声学捕获技术应用于allo-HSCT患者的血浆EV分离,验证了该技术从150μL血浆中富集EVs的可行性,并通过miRNA分析探索其作为并发症生物标志物的潜力,填补了声学捕获技术在allo-HSCT生物标志物研究中的空白。
3. 研究思路总结与详细解析
整体框架概括
研究目标是验证声学捕获的血浆EVs用于allo-HSCT并发症生物标志物发现的可行性;核心科学问题包括:①声学捕获能否从少量血浆中可靠分离EVs?②EVs的miRNA谱是否与全血浆不同?③EVs miRNA是否与临床指标相关?技术路线为:招募患者→采集血浆→声学捕获EVs→表征EVs特性→miRNA profiling→相关性分析。
3.1 患者招募与血浆样本收集
实验目的是获取allo-HSCT患者移植前后的血浆样本。方法细节:招募20例高危/复发血液恶性肿瘤患者(年龄21-71岁),移植前(第0周)及移植后12周内采集全血,用柠檬酸钠真空采血管(Becton Dickinson)收集,经两次1600×g离心15分钟获得血小板-free血浆,分装后-80℃保存。结果解读:共收集173份样本,所有患者完成3个月随访且无死亡。
实验所用关键产品:Becton Dickinson的柠檬酸钠真空采血管。
3.2 声学捕获法分离血浆EVs
实验目的是从少量血浆中分离EVs。方法细节:使用AcouSort AB的AcouTrap仪器,基于λ/2超声驻波原理,以12μm聚苯乙烯微珠(Sigma-Aldrich)为种子颗粒,处理150μL稀释(1:2 PBS)血浆,流速15μL/min,室温操作。EVs通过声波散射作用被捕获在种子颗粒簇中,随后洗脱用于下游分析。结果解读:成功分离所有样本的EVs,验证了小样本量处理的可行性。
实验所用关键产品:AcouSort AB的AcouTrap仪器、Sigma-Aldrich的12μm聚苯乙烯微珠、Qiagen的miRNeasy Serum/Plasma Kit(RNA提取)。
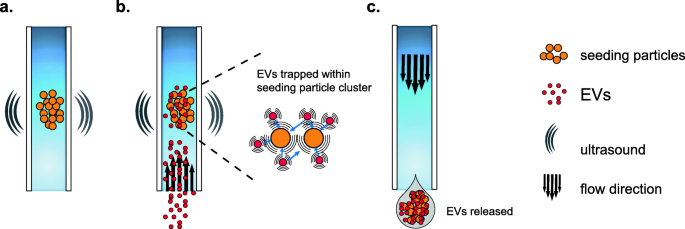
3.3 EVs数量与形态表征
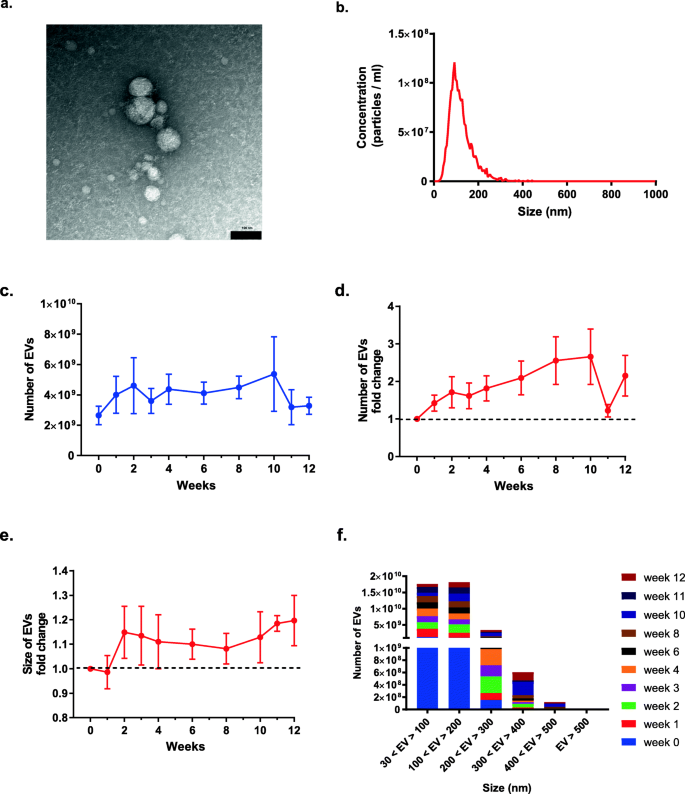
实验目的是分析EVs的基本特性。方法细节:用NanoSight LM10(Malvern Inc.)检测EVs数量与大小分布(每样本检测3次,每次30秒);用Tecnai Spirit BioTWIN透射电子显微镜(TEI)观察形态。结果解读:透射电镜显示EVs为圆形有膜结构(图2a);纳米颗粒跟踪分析显示EVs大小主要在30-200nm之间(图2b、f);移植后EVs数量较移植前增加2-7倍(图2c、d),大小略有增加(图2e)。
实验所用关键产品:Malvern Inc.的NanoSight LM10、TEI的Tecnai Spirit BioTWIN透射电子显微镜。
3.4 EVs与全血浆miRNA谱比较
实验目的是比较EVs包裹miRNA与全血浆游离miRNA的差异。方法细节:选取5例患者的5个时间点样本,分别提取EVs和全血浆的RNA(Qiagen miRNeasy Kit),用miRCURY LNA RT Kit反转录,通过miRCURY LNA miRNA PCR Panel(179个miRNA)进行qPCR分析(Roche LightCycler® 480系统)。结果解读:Venn图显示EVs中的miRNA并非全部存在于全血浆(图3a);无监督层次聚类分析显示EVs与全血浆样本的miRNA谱明显分离(图3b),例如miR-26a-5p在EVs中表达更高,miR-16-5p在EVs中表达更低,表明EVs包裹的miRNA具有独特性。
实验所用关键产品:Qiagen的miRNeasy Serum/Plasma Kit、miRCURY LNA RT Kit、miRCURY LNA miRNA PCR Panel、Roche的LightCycler® 480 Real-Time PCR System。

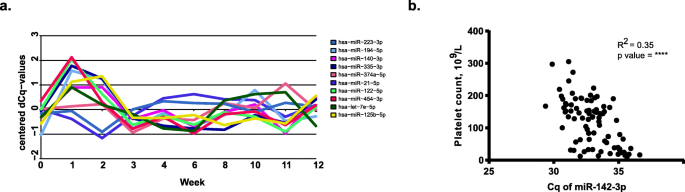
3.5 EVs miRNA与血小板计数的相关性分析
实验目的是验证EVs miRNA能否反映生理状态(以血小板相关miR-142-3p为例)。方法细节:检测EVs中miR-142-3p的表达水平,与患者外周血血小板计数进行Pearson相关分析。结果解读:miR-142-3p的表达与血小板计数显著正相关(r=0.35,p<0.0001)(图4b),验证了EVs miRNA能够反映生理状态。
文献未提及具体实验产品,领域常规使用qPCR试剂(如Qiagen的miRCURY LNA系列)进行miRNA表达检测。
3.6 EVs miRNA与感染、GvHD的相关性分析
实验目的是探索EVs miRNA与allo-HSCT并发症的相关性。方法细节:对14例感染患者(第1-6周)和4例GvHD患者(≥3次诊断)的EVs miRNA数据进行Spearman秩相关分析,按z-score排序筛选相关miRNA。结果解读:感染相关的top正相关miRNA包括miR-223-3p、miR-21-5p等,top负相关miRNA包括miR-425-5p、miR-342-3p等(图5a);GvHD相关的top正相关miRNA包括miR-15b-3p、miR-30a-5p等,top负相关miRNA包括miR-141-3p、miR-486-5p等(图5b)。
文献未提及具体实验产品,领域常规使用R软件进行相关性分析。

4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的Biomarker类型是血浆EVs中的miRNA;筛选/验证逻辑为:①基于20例患者的临床样本,用声学捕获技术分离EVs;②提取EVs RNA并进行miRNA profiling;③通过相关性分析筛选与血小板计数、感染及GvHD相关的miRNA;④验证miRNA表达与临床指标的相关性。
研究过程详述
Biomarker来源为allo-HSCT患者移植前后的血浆EVs;验证方法包括qPCR(检测miRNA表达)、Spearman秩相关及Pearson相关分析(关联临床指标);特异性与敏感性数据:miR-142-3p与血小板计数的相关系数r=0.35(p<0.0001);感染相关miRNA的z-score排序显示miR-223-3p等为top正相关,miR-425-5p等为top负相关;GvHD相关miRNA中miR-15b-3p等为top正相关,miR-141-3p等为top负相关(文献未提供AUC值)。
核心成果提炼
①血小板特异性miR-142-3p在EVs中的表达与血小板计数显著正相关(r=0.35,p<0.0001),验证了EVs miRNA反映生理状态的能力;②筛选出与感染正相关的miRNA(miR-223-3p、miR-21-5p等)和负相关的miRNA(miR-425-5p等);③筛选出与GvHD正相关的miRNA(miR-15b-3p、miR-30a-5p等)和负相关的miRNA(miR-141-3p等);④首次证实声学捕获的EVs miRNA具有独特性,且与allo-HSCT并发症相关,为并发症早期诊断提供了新的生物标志物候选。
本研究的创新性在于将声学捕获技术应用于allo-HSCT患者的EV分离,填补了该技术在allo-HSCT生物标志物研究中的空白,为临床小样本量EV分析提供了可行方案。
