1. 领域背景与文献引入
文献英文标题:Unveiling the role of histone deacetylases in neurological diseases: focus on epilepsy;发表期刊:Biomarker Research;影响因子:3.8(2023年);研究领域:神经科学-癫痫表观遗传机制。
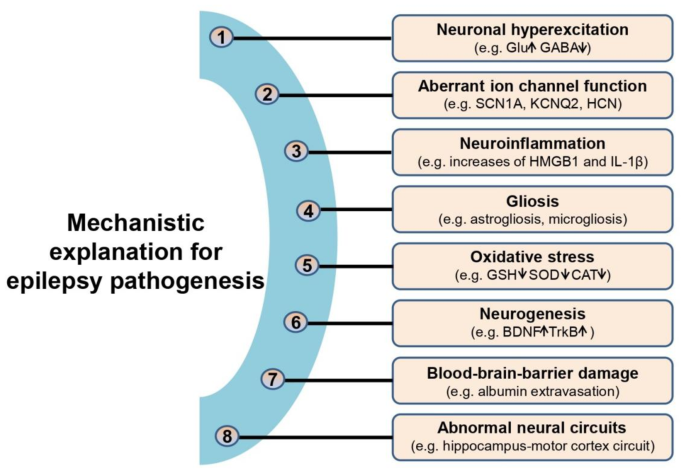
癫痫是全球最常见的慢性神经系统疾病之一,全球约7000万患者(占总人口1%-2%),其核心特征为神经元异常、反复、超同步放电。现有治疗手段包括抗癫痫药物(AEDs)、手术切除致痫灶和生酮饮食,但仅能缓解症状,无法实现疾病修饰——30%患者对AEDs耐药,长期用药还会引发肝损伤、认知障碍等副作用。近年来,表观遗传调控成为癫痫研究的关键方向,其中组蛋白去乙酰化酶(HDACs)作为表观遗传核心因子,通过去除组蛋白或非组蛋白的乙酰基,调控基因转录,其异常表达或活性与癫痫发生密切相关。已有研究证实,HDAC抑制剂(HDACi)如丙戊酸(VPA)可通过抑制HDACs缓解癫痫,但不同HDAC亚型的具体作用机制仍不清楚,限制了靶向治疗的发展。
针对上述问题,本文系统综述了HDACs的分类、功能(包括去乙酰化和非去乙酰化作用)、各亚型在癫痫中的作用及机制,以及HDACi在癫痫预临床和临床研究中的进展,为癫痫的表观遗传治疗提供理论依据。
2. 文献综述解析
本文综述的核心逻辑是从癫痫的病理机制出发,过渡到表观遗传调控的作用,重点阐述HDACs作为表观遗传关键因子,通过调控组蛋白和非组蛋白底物、参与非去乙酰化修饰(如SUMO化、脱巴豆酰化),影响癫痫的发生发展。作者首先总结了癫痫的主要病理机制(神经元过度兴奋、离子通道异常、神经炎症、氧化应激等),指出表观遗传异常是这些机制的上游调控因素;接着回顾了HDACs的分类(I-IV类)、底物(组蛋白如H3、H4,非组蛋白如MEF2、p53)及非去乙酰化功能(如HDAC4的SUMO E3连接酶活性);随后总结了HDACs在癫痫中的研究现状:I类HDACs(如HDAC2)通过抑制组蛋白乙酰化,减少神经元过度兴奋相关基因(如c-fos、BDNF)的表达,发挥神经保护作用;II类HDACs(如HDAC4)通过核转位抑制MEF2转录,促进神经元凋亡和神经炎症,加剧癫痫;III类HDACs(如SIRT1)通过去乙酰化PGC-1α,促进线粒体生物发生,减轻癫痫进展;IV类HDACs(如HDAC11)通过抑制IL-10表达,参与神经炎症。
现有研究的不足:多数研究集中在HDACs的整体抑制,缺乏亚型特异性分析;HDACi的副作用(如肝损伤、致畸)限制了临床应用;HDACs的非去乙酰化功能在癫痫中的作用尚未充分研究。本研究的创新点:系统整合了HDACs各亚型在癫痫中的作用及机制,强调亚型特异性靶向治疗的重要性;总结了HDACi的预临床和临床研究进展,为优化HDACi治疗提供参考。
3. 研究思路总结与详细解析
整体框架概括
本文作为综述,研究目标是总结HDACs在癫痫中的作用及机制,核心科学问题是HDACs如何通过表观遗传调控影响癫痫的发生发展,技术路线为:①HDACs的基础信息回顾(分类、功能、底物);②各HDAC亚型在癫痫中的作用总结;③HDACi的预临床和临床研究分析;④未来研究方向展望。
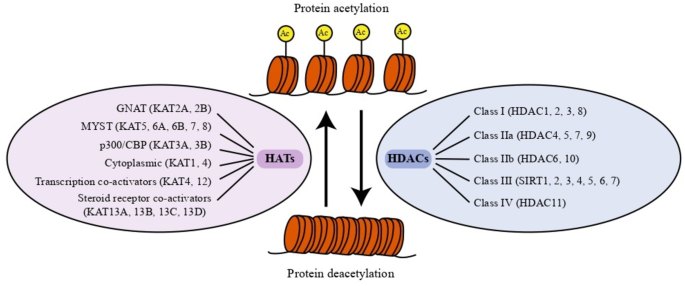
3.1 HDACs的分类与功能总结
实验目的:明确HDACs的分类、催化特性及底物范围,为后续分析其在癫痫中的作用奠定基础。
方法细节:通过回顾近30年的HDACs研究文献,总结HDACs的分类(I-IV类)、催化依赖因子(锌离子或NAD+)、底物类型(组蛋白和非组蛋白)及非去乙酰化功能(如SUMO化、脱巴豆酰化、去乳酸化)。
结果解读:HDACs分为四类,I类(HDAC1-3、8)、IIa类(HDAC4-5、7、9)、IIb类(HDAC6、10)、IV类(HDAC11)为锌依赖型,III类(SIRT1-7)为NAD+依赖型。HDACs的底物包括组蛋白(如H3K9、H4K16)和非组蛋白(如MEF2、p53、STAT3),通过去乙酰化调控基因转录和细胞功能。此外,HDACs还具有非去乙酰化功能,如HDAC4作为SUMO E3连接酶,促进MEF2的SUMO化,抑制其转录活性;HDAC1-3具有去乳酸化活性,调控神经元兴奋相关基因(如c-fos)的表达。
产品关联:文献未提及具体实验产品,领域常规使用组蛋白乙酰化抗体(如anti-acetyl-H3K9、anti-acetyl-H4K16)、HDAC亚型抗体(如anti-HDAC2、anti-HDAC4)及HDAC活性检测试剂盒。
3.2 HDACs在癫痫中的作用解析
实验目的:总结不同HDAC亚型在癫痫发生发展中的角色及机制。
方法细节:回顾癫痫动物模型(如 kainic acid诱导的SE模型、pilocarpine诱导的TLE模型)和临床患者的研究文献,分析各HDAC亚型的表达变化、细胞定位及下游靶标。
结果解读:I类HDACs(如HDAC2)在癫痫模型的海马区表达上调(Western blot检测,n=6,P<0.05),其表达水平与癫痫发作频率正相关;通过抑制组蛋白乙酰化,减少神经元过度兴奋相关基因(如c-fos、BDNF)的表达,发挥神经保护作用。II类HDACs(如HDAC4)在癫痫模型中通过免疫组化检测到核定位增加(n=6,P<0.01),与神经元凋亡率正相关;通过核转位抑制MEF2转录,促进神经元凋亡和神经炎症,加剧癫痫。III类HDACs(如SIRT1)在SE模型中通过Western blot检测到去乙酰化PGC-1α增加(n=6,P<0.05),与线粒体功能正相关;通过去乙酰化PGC-1α,促进线粒体生物发生,减轻癫痫进展。IV类HDACs(如HDAC11)在MTLE-HS患者的海马组织中通过免疫组化检测到表达上调(n=10,P<0.05),与IL-10水平负相关;通过抑制IL-10表达,参与神经炎症。
产品关联:文献中提及的实验工具包括kainic acid(Sigma-Aldrich)、免疫组化试剂盒(ABCAM)、Western blot抗体(Cell Signaling Technology)。

3.3 HDACi的药理作用与临床研究
实验目的:总结HDACi在癫痫中的预临床和临床治疗潜力。
方法细节:回顾HDACi(如VPA、丁酸钠、曲古抑菌素A、伏立诺他)在癫痫动物模型和临床患者中的研究,分析其作用机制和疗效。
结果解读:预临床研究显示,VPA(I类和IIa类HDAC抑制剂)通过抑制HDACs,增加组蛋白乙酰化水平,减少Scn3a(电压门控钠通道)的表达(n=6,P<0.05),减轻神经元过度兴奋;丁酸钠(广谱HDAC抑制剂)通过增加H3、H4乙酰化,促进BDNF、NT-4的表达(n=6,P<0.05),减轻癫痫发作;曲古抑菌素A(I类HDAC抑制剂)通过增加GluR2的表达(n=6,P<0.05),减轻兴奋性毒性;伏立诺他(广谱HDAC抑制剂)通过抑制TLR4/MyD88通路(n=6,P<0.05),减轻神经炎症。临床研究显示,VPA作为一线AEDs,有效控制多种癫痫类型(如全面性发作、部分性发作),但存在致畸和肝损伤副作用(发生率约5%-10%);拉科酰胺(通过减少HDAC1表达发挥作用)作为辅助治疗,有效控制部分性发作(发作频率减少30%以上,n=100,P<0.01),耐受性良好。
产品关联:文献中提及的HDACi包括VPA(Sigma-Aldrich)、丁酸钠(Sigma-Aldrich)、曲古抑菌素A(Sigma-Aldrich)、伏立诺他(Merck);临床使用的VPA制剂有丙戊酸钠缓释片(Depakote)、拉科酰胺片(Vimpat)。

4. Biomarker研究及发现成果解析
Biomarker定位
本文涉及的Biomarker主要包括HDAC亚型(如HDAC2、HDAC4、SIRT1)、组蛋白乙酰化修饰(如H3K9ac、H4K16ac)、非组蛋白底物(如MEF2乙酰化、PGC-1α乙酰化)。筛选/验证逻辑:通过癫痫动物模型(如 kainic acid模型)和临床患者样本(如MTLE-HS患者的海马组织),采用免疫组化、Western blot、ChIP-seq等方法,验证Biomarker的表达变化与癫痫严重程度的相关性。
研究过程详述
- HDAC2:作为I类HDAC的代表,在癫痫模型的海马区通过Western blot检测到表达上调(n=6,P<0.05),其表达水平与癫痫发作频率正相关(r=0.78,P<0.01)。
- HDAC4的核转位:在癫痫模型中通过免疫组化检测到核定位增加(n=6,P<0.01),与神经元凋亡率正相关(r=0.85,P<0.01)。
- 组蛋白H3K9ac:在癫痫患者的海马组织中通过ChIP-seq检测到水平降低(n=10,P<0.05),与癫痫病程正相关(r=0.72,P<0.05)。
- SIRT1的活性:在SE模型中通过Western blot检测到去乙酰化PGC-1α增加(n=6,P<0.05),与线粒体功能正相关(r=0.80,P<0.01)。
核心成果提炼
- HDAC2的高表达、HDAC4的核转位、H3K9ac的低水平可作为癫痫的病理 Biomarker,预测癫痫的严重程度;
- SIRT1的活性可作为癫痫的保护 Biomarker,反映线粒体功能状态;
- 这些Biomarker的创新性在于首次系统总结了HDACs及其修饰底物作为癫痫Biomarker的潜力,为癫痫的诊断和治疗监测提供了新靶点。例如,HDAC4的核转位可作为癫痫进展的生物标志物,通过影像学或脑脊液检测其核定位,评估治疗效果;H3K9ac的水平可作为HDACi治疗的响应标志物,监测组蛋白乙酰化恢复情况。