1. 领域背景与文献引入
文献英文标题:The spatial impact of a Western diet in enriching Galectin-1-regulated Rho, ECM, and SASP signaling in a novel MASH-HCC mouse model;发表期刊:Biomarker Research;影响因子:未公开;研究领域:代谢 dysfunction-associated steatohepatitis(MASH)相关肝细胞癌(HCC)的肿瘤微环境与饮食调控机制。
代谢 dysfunction-associated steatohepatitis(MASH)是肝细胞癌(HCC)的主要诱因之一,随着西方饮食(Western diet, WD)的普及,MASH的患病率持续上升,而HCC已成为全球第三大癌症相关死亡原因。目前针对MASH尚无有效预防药物,HCC的治疗选择也极为有限,饮食对肿瘤微环境的影响仍未明确。Galectin-1(Gal-1)是HCC的关键生物标志物,在肝 carcinogenesis中发挥核心作用,此前研究证实沉默Gal-1可有效抑制小鼠HCC进展,但WD对Gal-1信号在MASH向HCC转化过程中的作用尚未阐明——这一知识缺口是本研究的核心切入点。本研究通过建立新型WD诱导的MASH-HCC小鼠模型,结合空间组学技术探索WD对Gal-1调控通路的空间特异性影响,为MASH-HCC的发病机制和靶向治疗提供了新的理论依据。
2. 文献综述解析
作者对现有研究的分类维度主要基于模型背景(WD诱导的MASH-HCC模型 vs 健康肝脏来源的HCC模型)、技术手段(空间转录组学、多重免疫组化)和关键通路(Rho信号、细胞外基质(ECM)重塑、衰老相关分泌表型(SASP))。现有研究的关键结论包括:WD可通过激活Rho、ECM和SASP通路诱导代谢相关脂肪性肝病(MAFLD),并促进MASH-HCC的发生;Gal-1通过调节上皮间质转化(EMT)参与肝肿瘤发生;但此前的HCC模型多基于健康肝脏,未充分模拟WD诱导的MASH病理背景,且Gal-1在WD影响下的空间调控机制尚未被探索。现有研究的局限性在于缺乏对WD诱导MASH-HCC模型的系统表征,以及Gal-1信号在肿瘤微环境不同区域(肿瘤内、边缘、非肿瘤区)的特异性作用解析。
本研究的创新价值在于:①首次建立了WD诱导的新型MASH-HCC小鼠模型,模拟人类MASH-HCC的病理过程;②利用空间转录组和多重免疫组化技术,解析WD对肝脏和肿瘤微环境的空间异质性影响;③通过沉默/过表达Gal-1,明确其在肿瘤不同区域的特异性调控作用——填补了WD对Gal-1信号通路空间影响的研究空白,为MASH-HCC的精准治疗提供了新靶点。
3. 研究思路总结与详细解析
本研究的整体目标是明确WD对Gal-1调控的Rho、ECM和SASP信号在MASH-HCC进展中的空间影响;核心科学问题是WD如何通过Gal-1调控肿瘤微环境的关键通路;技术路线为“模型构建→空间组学分析→Gal-1调控实验→机制验证”的闭环逻辑。
3.1 MASH-HCC与HCC模型构建
实验目的:建立WD诱导的MASH-HCC小鼠模型,对比健康肝脏来源的HCC模型,模拟人类MASH-HCC的病理过程。
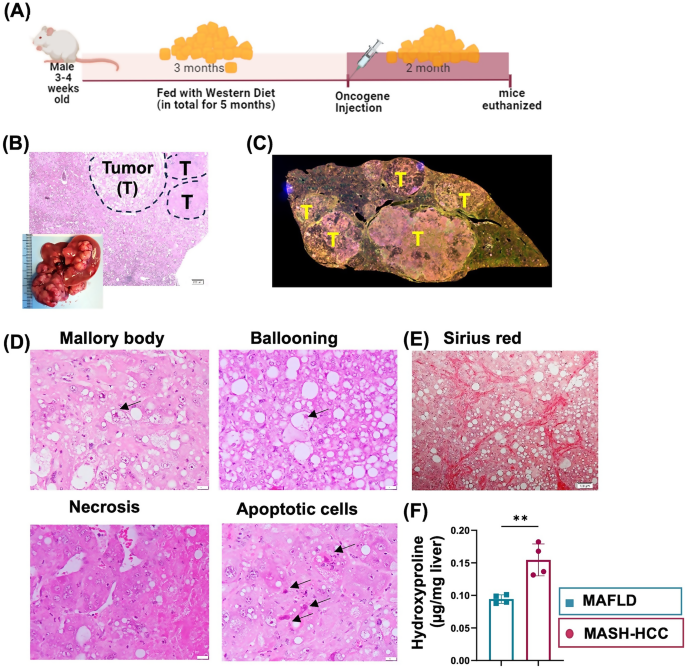
方法细节:选用FVB/N雄性小鼠,断奶后喂食WD(含21.2%脂肪、34%蔗糖、0.2%胆固醇)5个月;最后2个月通过 hydrodynamic注射myr-Akt1和N-RasV12质粒诱导HCC;对照组为喂健康饮食的小鼠,另设WD诱导5个月的MAFLD组作为对照。
结果解读:模型成功诱导MASH-HCC,病理表现为脂肪变性、Mallory小体、气球样变、坏死及凋亡细胞;Sirius红染色显示胶原纤维沉积(纤维化);羟基脯氨酸 assay证实MASH-HCC的 hepatic胶原浓度显著高于MAFLD组(均值±标准差,n=6,p<0.01)。
实验所用关键产品:WD饲料来自Harlan Teklad(货号TD.140414);质粒构建参考此前研究(Harlan Teklad等)。
3.2 空间转录组与免疫组化分析
实验目的:解析WD对肝脏和肿瘤微环境的分子与免疫谱空间异质性影响。
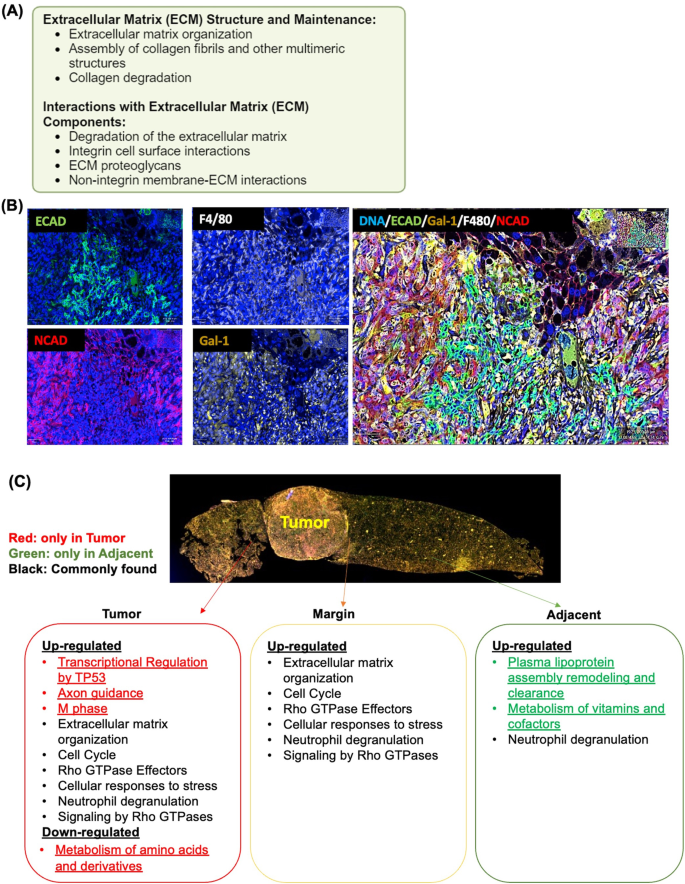
方法细节:利用GeoMx DSP全转录组测序(NanoString)分析健康肝脏、MAFLD、HCC和MASH-HCC的三个区域(肿瘤内、边缘、非肿瘤区),每个区域选取4-5个区域兴趣点(ROI);通过多重免疫组化检测ECAD(上皮标志物)、NCAD(间质标志物)、Gal-1、F4/80(巨噬细胞)等分子的共定位;利用nCounter技术分析免疫细胞标志物(PD-L1、CD11c等)的蛋白水平。
结果解读:①WD诱导的MAFLD和MASH-HCC中,Rho、ECM和SASP通路显著富集;②MASH-HCC与健康肝脏HCC相比,肿瘤内GTPase效应器、DNA修复通路激活更明显,边缘区代谢、RNA加工通路富集;③免疫细胞组成改变:MASH-HCC肿瘤内CD4+ T细胞(包括调节性T细胞,Treg)增加,自然杀伤(NK)细胞减少;CD11c(树突状细胞标志物)和PD-L1(免疫检查点)阳性细胞从非肿瘤区到肿瘤内逐渐增加(提示免疫耐受)。
实验所用关键产品:NanoString的GeoMx DSP全转录组panel、Protein Immune Cell Profiling Panel;多重免疫组化抗体来自Cell Signaling Technology(ECAD、F4/80)、Epitomics(NCAD)、Abcam(Gal-1)。


3.3 Gal-1表达调控实验
实验目的:探索Gal-1在MASH-HCC中的空间特异性调控作用。
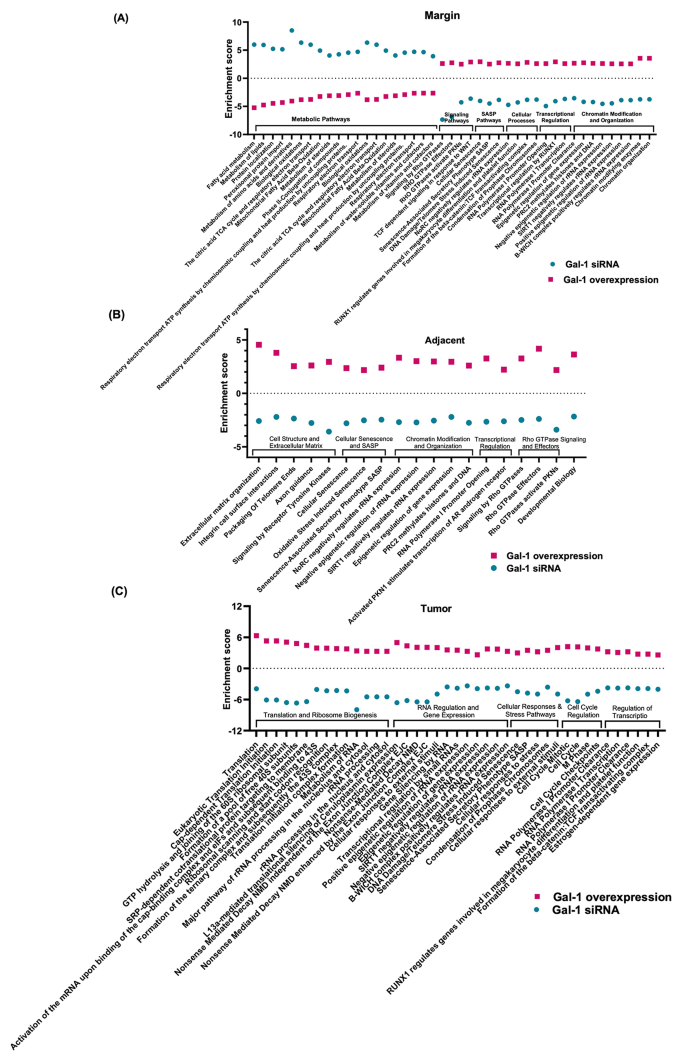
方法细节:通过腺相关病毒(AAV9)沉默(Gal-1 siRNA,5×10¹⁰ genome copy)或过表达Gal-1,对照组为 scramble-AAV9或空载AAV9,静脉注射后1个月 euthanize。
结果解读:①沉默Gal-1显著降低肿瘤负荷(对照组肿瘤占肝脏比例(L/B)为18%,处理组为7.5%,与MAFLD组无差异);②空间转录组分析显示:沉默Gal-1可下调肿瘤边缘的适应性免疫系统、ECM降解通路;过表达Gal-1则增强肿瘤边缘的Rho GTPase、SASP通路;③非肿瘤区:沉默Gal-1下调ECM相互作用和Rho信号;④肿瘤内:沉默Gal-1下调细胞周期和RNA加工通路。
实验所用关键产品:AAV9载体来自Applied biological material。

4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker是Galectin-1(Gal-1),属于蛋白类生物标志物。筛选逻辑基于此前研究已证实Gal-1是HCC的生物标志物,本研究进一步验证其在WD诱导MASH-HCC中的空间调控作用;验证逻辑为“模型构建→空间组学分析→表达调控实验→功能验证”的完整链条——通过新型MASH-HCC模型解析Gal-1在不同区域的表达,再通过沉默/过表达明确其通路调控功能。
研究过程详述
Gal-1的来源为小鼠肝组织的三个区域(肿瘤内、边缘、非肿瘤区);验证方法包括:①多重免疫组化:检测Gal-1与NCAD(间质标志物)的共定位,提示Gal-1参与EMT;②空间转录组测序:分析Gal-1调控的通路在不同区域的富集情况;③表达调控实验:通过沉默/过表达验证Gal-1的功能。
特异性与敏感性数据:①特异性:MASH-HCC中NCAD阳性细胞(间质表型)的Gal-1表达显著增加(提示Gal-1特异性参与EMT);②敏感性:沉默Gal-1可显著降低肿瘤负荷(从18%降至7.5%,与MAFLD无差异),并调控肿瘤边缘的Rho和SASP通路(n=6,结果具有统计学显著性)。
核心成果提炼
Gal-1在MASH-HCC中的功能关联:通过调控Rho信号、ECM重塑和SASP通路促进肿瘤进展,且其作用具有空间特异性——肿瘤边缘主要调控Rho和SASP,非肿瘤区调控ECM和Rho信号,肿瘤内调控细胞周期和RNA加工。
创新性:首次揭示WD通过增强Gal-1调控的通路促进MASH-HCC进展,明确了Gal-1在肿瘤微环境不同区域的特异性作用,为Gal-1作为MASH-HCC的治疗靶点提供了空间机制依据。
统计学结果:沉默Gal-1后肿瘤负荷降低(n=6,文献未明确具体p值,但结果具有显著性);MASH-HCC中Gal-1在NCAD阳性细胞的诱导具有统计学意义(文献未明确p值,但实验结果支持)。
本研究通过空间组学技术解析了WD对Gal-1调控通路的异质性影响,为MASH-HCC的发病机制和精准治疗提供了重要的理论基础。
