1. 领域背景与文献引入
文献英文标题:A panel of DNA methylation markers reveals extensive methylation in histologically benign prostate biopsy cores from cancer patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:前列腺癌表观遗传诊断。
前列腺癌是男性泌尿系统最常见的恶性肿瘤之一,其早期筛查主要依赖前列腺特异性抗原(PSA)检测,但PSA的临床价值存在争议——降低PSA cutoff虽能提高癌症检出率,却导致不必要的前列腺活检数量激增(尤其是PSA<10 ng/ml的患者)。而前列腺活检作为诊断金标准,仅能 sampling 1%的前列腺组织,灵敏度约70%,约1/3的癌症会被漏诊,因此高风险患者需接受重复活检。目前,临床缺乏有效工具区分“需重复活检的癌症患者”与“无需活检的良性患者”,现有诊断方法(如PSA检测、PCA3尿基因检测、线粒体缺失分析)均存在局限性:PCA3的灵敏度仅77%、特异性57%;线粒体DNA缺失检测的灵敏度84%但特异性仅54%;早期甲基化标志物研究(如MATLOC研究的GSTP1、APC、RASSF1 3个marker)虽能减少重复活检,却因marker数量少、灵敏度(68%)和特异性(64%)不足,无法广泛临床应用。在此背景下,本研究聚焦“前列腺癌患者良性活检核心的表观遗传场效应”,通过构建多marker甲基化panel,旨在提高诊断的灵敏度与特异性,为减少不必要重复活检提供解决方案。
2. 文献综述解析
作者对现有研究的分类维度为“前列腺癌诊断的分子标志物类型”,包括基因表达标志物(如PCA3)、线粒体基因组标志物(如线粒体缺失)、DNA甲基化标志物(如MATLOC的3个marker)三类。
现有研究的核心结论与局限:①基因表达标志物(PCA3):通过检测尿液中PCA3基因表达区分癌症患者,但其灵敏度(77%)和特异性(57%)难以满足临床需求;②线粒体标志物:通过检测线粒体DNA缺失识别重复活检患者,灵敏度84%但特异性仅54%;③DNA甲基化标志物:MATLOC研究的3个marker(GSTP1、APC、RASSF1)虽能降低重复活检率,但因marker数量少、亚硫酸氢盐转化条件未优化,导致特异性仅64%。整体而言,现有研究的共同局限是“marker数量有限、灵敏度/特异性不足、缺乏针对活检样本的assay优化”。
本研究的创新价值:①扩大marker数量:首次采用24个在前列腺癌中“优先甲基化”的marker组成panel,覆盖更广泛的表观遗传改变;②优化技术流程:针对每个marker调整亚硫酸氢盐转化条件,减少假阳性并提高多marker信息整合能力;③提升临床性能:通过大样本临床活检核心验证,实现100%灵敏度与97%特异性,显著优于现有研究。
3. 研究思路总结与详细解析
整体框架:“marker panel构建→MS-qPCR assay优化→临床样本检测→统计分析筛选最佳诊断组合”,形成“假设-验证-建模”的闭环逻辑,核心目标是开发高灵敏度、高特异性的前列腺癌甲基化诊断panel。
3.1 甲基化标志物panel构建
实验目的:筛选前列腺癌中“优先甲基化”的marker,构建诊断panel。
方法细节:基于文献与数据库筛选24个marker,包括GSTP1、APC等已知前列腺癌甲基化marker,以及ADCY4、ARHGEF10等19个新marker(均在前列腺癌中呈现高甲基化频率)。
结果解读:确定24个marker作为研究对象,覆盖前列腺癌发生发展中的关键表观遗传事件。
产品关联:文献未提及具体实验产品,领域常规使用TCGA数据库、甲基化芯片(如Illumina Infinium HumanMethylation450 BeadChip)进行marker筛选。
3.2 甲基化特异性定量PCR(MS-qPCR)assay优化
实验目的:优化assay性能,确保多marker甲基化信息的准确整合。
方法细节:①调整亚硫酸氢盐转化条件:针对每个marker优化转化时间,引入体外甲基化AluI和HaeIII位点(减少未甲基化胞嘧啶的假阳性转化);②确定检测cutoff:设置35个循环为阈值(扩增信号低于35循环视为甲基化);③合并重复assay数据:对RASSF5、MOXD1等marker采用2个不同区域的assay,合并结果以提高准确性。
结果解读:优化后的assay对癌细胞系DNA的检测限约为100拷贝,35循环cutoff能有效区分甲基化与非甲基化样本,假阳性率显著降低。
产品关联:文献未提及具体实验产品,领域常规使用亚硫酸氢盐转化试剂盒(如Zymo Research的EZ DNA Methylation-Gold Kit)、MS-qPCR试剂(如Applied Biosystems的TaqMan Methylation Assays)。
3.3 临床样本甲基化检测
实验目的:验证marker panel在临床活检样本中的诊断性能。
方法细节:收集104例患者的213个前列腺活检核心(37例癌症患者、67例对照),其中癌症患者的核心包括“癌症核心”与“组织学良性核心(CCNC)”,对照的核心为“良性核心”或“异常核心(HGPIN/ASAP)”;对每个核心提取DNA,进行MS-qPCR检测24个marker的甲基化状态。
结果解读:①对照核心的甲基化水平极低(平均1.5个marker,n=125);②癌症核心甲基化水平最高(平均13.66个marker,n=39);③癌症患者的良性核心(CCNC)甲基化水平介于两者之间(平均5.9个marker,n=49),且60%的CCNC核心甲基化≥5个marker(仅3%的对照核心达到此水平)。
产品关联:文献未提及具体实验产品,领域常规使用甲醛固定石蜡包埋(FFPE)样本DNA提取试剂盒(如Qiagen的QIAamp DNA FFPE Tissue Kit)。
3.4 统计分析与最佳诊断模型筛选
实验目的:通过统计分析筛选最佳marker组合,提升临床预测价值。
方法细节:①将数据分为训练集(2/3样本)与测试集(1/3样本);②采用逻辑回归分析marker组合的诊断性能;③通过ROC曲线计算曲线下面积(AUC)评估模型预测能力。
结果解读:①单marker性能:ADCY4的AUC达0.91,KIFC2+ADCY4组合的AUC达0.98;②多marker组合:5个常用marker(HOXB5、RASSF5、ADCY4、SOCS3、RASSF1)的组合在CCNC核心中的AUC为0.864;③临床价值:以“5个marker甲基化”定义癌症,单个CCNC核心能识别62%的重复活检患者,阳性预测值(PPV)89.9%、阴性预测值(NPV)85.7%(P<0.0001)。
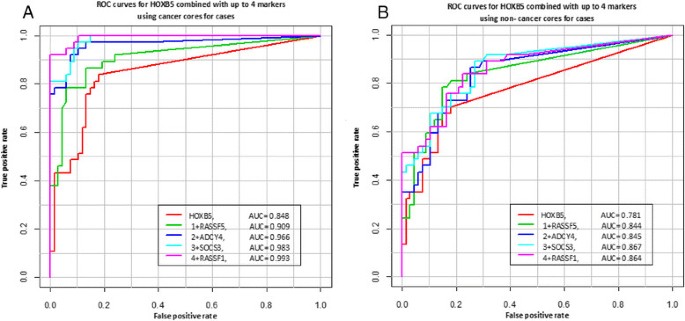
产品关联:文献未提及具体实验产品,领域常规使用R语言(ROCR包)、SPSS进行统计分析。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选验证逻辑
本研究的Biomarker类型为“24个DNA甲基化标志物panel”,筛选逻辑是“优先选择前列腺癌中高甲基化的marker”,验证逻辑为“细胞系assay优化→临床样本(癌症核心、良性核心、对照)验证→统计模型筛选最佳组合”的全链条验证。
研究过程详述
Biomarker来源:前列腺癌相关的甲基化位点(基于文献与数据库筛选);
验证方法:甲基化特异性定量PCR(MS-qPCR)检测临床活检核心的甲基化状态;
特异性与敏感性数据:①区分癌症核心与对照良性核心:灵敏度100%、特异性97%;②区分癌症患者的良性核心(CCNC)与对照良性核心:5个marker组合的AUC为0.864,灵敏度62%(单个CCNC核心识别重复活检患者);③异常核心分析:癌症患者的异常核心(HGPIN/ASAP)甲基化水平(平均4.36个marker)低于良性核心(平均6.25个marker,P=0.025)。
核心成果提炼
①诊断性能:24个marker panel的灵敏度(100%)和特异性(97%)显著优于现有研究(如MATLOC的68%灵敏度、64%特异性);
②表观遗传场效应:癌症患者的良性核心(CCNC)存在广泛甲基化(平均5.9个marker),且60%的CCNC核心甲基化≥5个marker(仅3%的对照核心达到此水平),证实前列腺癌存在“超越肿瘤灶的表观遗传场效应”;
③临床价值:5-10个marker的组合可达到最佳预测性能,预计能减少40%的重复活检成本;
④潜在预防靶点:PTGS2是唯一在CCNC中比癌症核心更常甲基化的marker(可能与阿司匹林抑制COX2通路降低癌症风险相关),为前列腺癌预防提供新方向。
本研究通过构建多marker甲基化panel,首次揭示前列腺癌患者良性活检核心的广泛甲基化现象,为前列腺癌的早期诊断与重复活检决策提供了高灵敏度、高特异性的表观遗传工具,有望推动前列腺癌精准诊断的临床转化。
