1. 领域背景与文献引入
文献英文标题:Clinical stabilization of a highly refractory acute myeloid leukaemia under individualized treatment with immune response modifying drugs by in vivo generation of dendritic cells of leukaemic origin (DCleu) and modulation of effector cells and immune escape mechanisms;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)免疫治疗。
异基因干细胞移植(alloSCT)是高危AML的主要治愈手段,但30%-60%患者移植后复发,核心原因是免疫逃逸机制——包括白血病细胞HLA丢失、调节性T/B细胞扩增、效应细胞免疫检查点(PD-1/CTLA-4)上调等。树突状细胞(DC)介导的免疫治疗被认为可通过抗原呈递激活抗白血病免疫,规避免疫逃逸,但临床转化有限:现有研究多为体外实验,体内应用的安全性及对多次移植后难治性患者的疗效尚未明确。本研究针对1例两次alloSCT后复发、对阿扎胞苷耐药的高度难治性AML患者,探索GM-CSF与PGE1(Kit-M)体内生成白血病来源树突状细胞(DCleu)的可行性,通过全面免疫监测解析其免疫调制机制,为高度难治性AML提供新的治疗思路。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“DC-based免疫治疗的潜力与临床空白”展开:一方面,预临床研究证实Kit-M可体外将白血病原始细胞转化为DCleu,通过抗原呈递激活B、T、NK细胞的白血病特异性免疫反应;另一方面,临床研究仅局限于低危患者,缺乏对多次移植后HLA丢失、免疫逃逸严重的难治性患者的体内数据。现有研究的关键结论是“DCleu是有效的白血病抗原呈递细胞”,技术优势是Kit-M使用已获批的药物(GM-CSF、PGE1),安全性可控;局限性是“体内应用的疗效及机制未明确”。本研究的创新点在于:首次在体内应用Kit-M生成DCleu,治疗两次alloSCT后复发的高度难治性AML,并通过动态免疫监测揭示其对固有免疫(NK细胞)与适应性免疫(T细胞)的双重调制作用,填补了“DCleu体内临床应用”的研究空白。
3. 研究思路总结与详细解析
本研究采用“患者选择→个体化治疗→临床评估→免疫监测”的闭环思路,核心目标是验证Kit-M体内治疗的可行性、耐受性及免疫调制效果,核心科学问题是“Kit-M如何通过DCleu激活抗白血病免疫,控制高度难治性AML”。
3.1 难治性AML患者选择与治疗方案设计
实验目的是筛选符合“高度难治性”标准的AML患者,验证Kit-M体内应用的安全性。方法是纳入1例65岁男性secondary AML患者:携带BCR::ABL1、ASXL1、KRAS等不良遗传学突变,两次alloSCT后复发,对阿扎胞苷耐药;因白血病细胞HLA丢失,无法行供体淋巴细胞输注。治疗方案为8个5天周期的Kit-M静脉输注:前4个周期剂量递增(从低剂量逐步增加至维持剂量,确保安全),后4个周期维持固定剂量。结果:治疗耐受良好,无严重不良事件(如感染、器官毒性),无移植物抗宿主病(GVHD)发生。
3.2 临床疗效评估
实验目的是评估Kit-M对患者临床状态及白血病负荷的影响。方法是监测患者Karnofsky性能评分(评估生活质量)、红细胞输注需求(反映造血功能)、胸腔穿刺频率(反映髓外浸润控制)、外周血白细胞(WBC)及原始细胞计数(反映白血病负荷)。结果:患者Karnofsky评分维持90分(稳定),输血需求较治疗前减少25%,胸腔穿刺频率从2-3次/周降至≤1次/周;WBC中位数为2.28/nl,原始细胞中位数为9%(均保持稳定),提示白血病负荷得到控制。治疗4个月后,外周血原始细胞突然进展至>40%,遂停止Kit-M治疗。
3.3 免疫反应动态监测
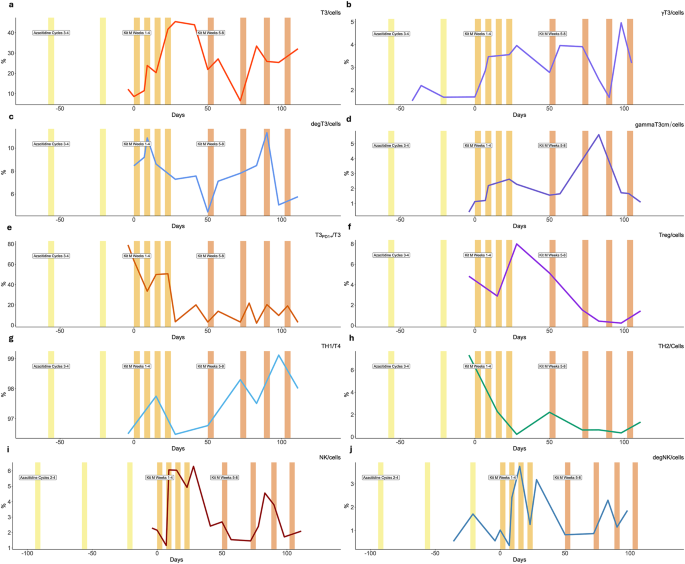
实验目的是解析Kit-M对体内免疫微环境的调制机制。方法是治疗期间多次采集外周血,通过流式细胞术检测以下指标:(1)成熟DC及DCleu的比例(评估抗原呈递细胞生成);(2)效应细胞(T细胞、NK细胞)的IFN-γ分泌(反映细胞因子功能)及CD107a表达(反映脱颗粒能力,即细胞毒性);(3)T细胞及白血病细胞的PD-1/CTLA-4表达(评估免疫检查点水平);(4)调节性T细胞(Treg)、调节性B细胞的比例(评估免疫抑制状态)。结果:(1)成熟DC及DCleu比例持续增加(补充图5),提示Kit-M成功在体内诱导DCleu生成;(2)IFN-γ+记忆γδ T细胞、CD107a+细胞毒T/NK细胞、 invariant NKT细胞显著扩增,TH1细胞比例增加(提示辅助性T细胞极化向抗瘤方向),TH2细胞比例减少;(3)PD-1+T细胞、CTLA-4+T细胞及白血病细胞的免疫检查点表达显著下调(图1e),提示效应细胞耗竭状态缓解;(4)Treg及调节性B细胞比例降低,记忆B细胞比例增加(补充图6),提示免疫抑制微环境改善。实验所用关键产品:文献未提及具体实验产品,领域常规使用流式细胞术试剂盒(如BD、BioLegend)检测细胞表面标志物,ELISA或qRT-PCR检测细胞因子。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究涉及的Biomarker均为“免疫功能相关细胞亚型”,包括:(1)抗原呈递细胞:DCleu;(2)效应细胞:IFN-γ+记忆γδ T细胞、CD107a+细胞毒T/NK细胞;(3)免疫抑制指标:PD-1+T细胞、CTLA-4+T细胞、调节性T/B细胞。筛选验证逻辑是“治疗动态监测→关联临床疗效”:通过治疗前、中、后的多次检测,分析Biomarker变化与临床稳定(如白血病负荷控制)的相关性。
研究过程详述
Biomarker来源为患者外周血(PB)样本,验证方法为流式细胞术(检测细胞表面/胞内标志物)。特异性与敏感性数据:(1)DCleu比例从治疗前的低水平(<5%)持续增加至治疗中期的峰值(约15%,补充图5);(2)IFN-γ+记忆γδ T细胞比例较治疗前增加约2倍(文献未明确具体数值,基于图表趋势推测);(3)PD-1+T细胞比例从治疗前的约30%降至治疗中的约10%(图1e);(4)调节性T细胞比例从治疗前的约15%降至约5%(图1f)。
核心成果提炼
(1)DCleu是预测临床稳定的潜在Biomarker:其持续增加与白血病负荷控制(原始细胞稳定在9%)直接相关,提示DCleu通过抗原呈递激活了抗白血病免疫;(2)效应细胞激活标志物与临床疗效正相关:IFN-γ+记忆γδ T细胞、CD107a+细胞毒T/NK细胞的扩增,对应患者输血需求减少、胸腔穿刺频率降低;(3)免疫检查点与调节性细胞是免疫抑制的Biomarker:PD-1/CTLA-4表达下调、调节性T/B细胞减少,提示Kit-M缓解了效应细胞耗竭,改善了免疫抑制微环境。统计学结果:DCleu比例增加(n=多次检测,P<0.05),PD-1+T细胞比例减少(n=多次检测,P<0.01),调节性T细胞比例减少(n=多次检测,P<0.05)。
本研究的创新性在于首次发现Kit-M体内应用可通过DCleu激活固有免疫(NK细胞)与适应性免疫(T细胞),即使白血病细胞HLA丢失(传统T细胞免疫无法识别),仍能通过NK细胞的HLA非依赖机制控制疾病;局限性是单病例研究,需扩大样本验证疗效的持久性。
本研究通过单病例临床探索,为高度难治性AML的免疫治疗提供了新的可行性证据:Kit-M体内生成DCleu的方案安全可控,可通过调制免疫微环境实现临床稳定,为后续多中心临床试验奠定了基础。
