1. 领域背景与文献引入
文献英文标题:CAR-T cell potency: from structural elements to vector backbone components;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗中的CAR-T细胞疗法
嵌合抗原受体T细胞(CAR-T)疗法是肿瘤免疫治疗的革命性突破,其发展历经关键节点:1993年Eshhar等提出第一代CAR(仅含CD3ζ激活域),2009年第二代CAR(加入共刺激域如CD28/4-1BB)提升疗效,2017年FDA批准首个CAR-T产品Tisagenlecleucel(Kymriah)用于儿童B细胞急性淋巴细胞白血病(B-ALL),截至2022年已有6款FDA批准的CAR-T产品(靶向CD19、BCMA等)。当前研究热点聚焦于优化CAR结构(如单链可变片段(scFv)的亲和力调整、铰链/跨膜域的长度选择、共刺激域的组合)和载体骨架元件(如慢病毒载体的启动子、信号肽、WPRE等),以解决CAR-T的核心问题:① 持久性差(如CD28共刺激域的CAR-T易耗竭);② 毒性风险(如细胞因子释放综合征(CRS)、神经毒性);③ 实体瘤疗效有限(如肿瘤微环境穿透性差、抗原异质性);④ 载体的插入突变风险(慢病毒随机整合可能激活原癌基因)。
现有研究多关注单个CAR元件或载体元件的作用,但对元件间协同效应(如scFv与铰链的组合如何影响抗原识别、共刺激域与跨膜域的组合如何调控信号传导)的系统分析不足。本文旨在整合CAR结构元件与载体骨架的研究进展,揭示两者对CAR-T效力的协同影响,为理性设计更安全、有效的CAR-T产品提供理论基础。
2. 文献综述解析
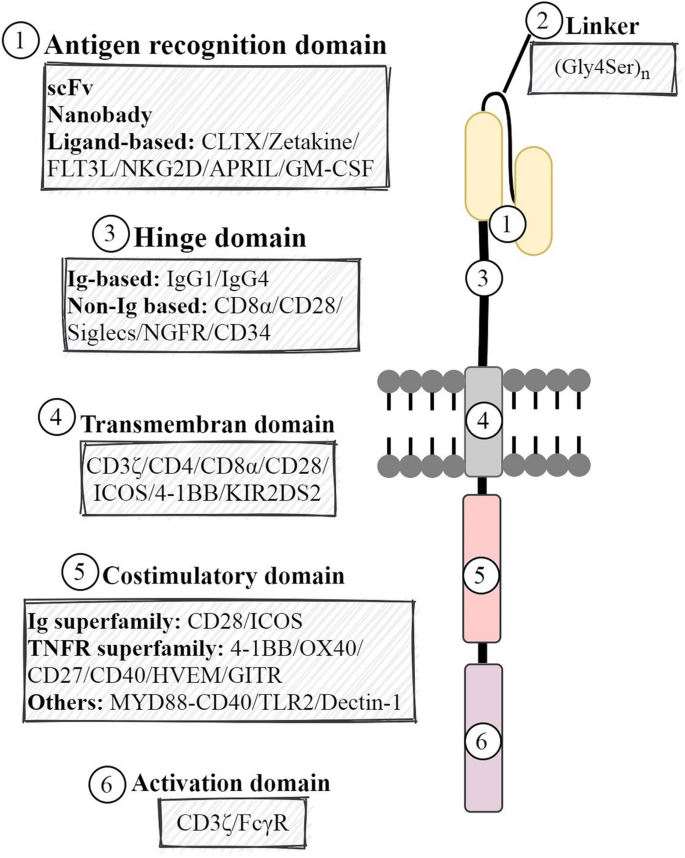
作者对现有研究的分类维度为:① CAR的结构模块(胞外域、跨膜域、内域);② 载体骨架的关键元件(启动子、信号肽、RRE、cPPT、WPRE等)。
现有研究的核心结论与局限性
关键结论:
- 胞外域:scFv的亲和力需“平衡”——过高易引发“on-target off-tumor”毒性(如识别正常组织低表达的抗原),过低则无法有效结合肿瘤抗原;人源或纳米抗体(如BCMA靶向的VHH)可降低免疫原性;铰链长度需匹配靶抗原的膜距离(如膜近端抗原需长铰链,膜远端抗原可短铰链)。
- 跨膜与内域:CD28跨膜域促进CAR二聚化,增强细胞因子分泌(如IL-2、IFN-γ),但易导致T细胞耗竭;4-1BB跨膜域/共刺激域可诱导中枢记忆T细胞(TCM,CD45RA+CCR7+)形成,显著提升CAR-T的体内持久性;激活域CD3ζ的单个免疫受体酪氨酸激活基序(ITAM)即可维持 potent 信号传导,减少“tonic signaling”(抗原非依赖的持续激活,导致T细胞耗竭)。
- 载体元件:EF1α启动子比CMV启动子更稳定(避免启动子沉默);信号肽(如CD8α)促进CAR的膜定位;Rev反应元件(RRE)加速病毒RNA的核输出;中央多嘌呤 tract(cPPT)形成DNA flap,增强慢病毒DNA的核输入;Woodchuck肝炎病毒转录后调控元件(WPRE)可提高CAR mRNA的加工效率,显著增强基因表达。
局限性:
- 对“元件协同作用”的研究不足(如scFv亲和力与铰链长度的组合如何影响抗原识别效率);
- 载体的插入突变风险未完全解决(慢病毒随机整合可能激活原癌基因);
- 实体瘤CAR-T的设计仍受限于肿瘤微环境的免疫抑制(如PD-1/PD-L1通路激活);
- 缺乏对CAR-T体内命运的长期追踪(如临床中CAR-T的持久性与疗效的动态关联)。
文献的创新价值
本文的核心创新在于系统整合CAR结构与载体骨架的研究,强调“元件协同效应”对CAR-T效力的决定性作用——例如:① 铰链与跨膜域的组合影响CAR二聚化(CD28铰链+CD28跨膜域易形成二聚体,增强信号传导但增加毒性);② 共刺激域与启动子的组合调控CAR表达(4-1BB共刺激域+EF1α启动子可同时提升持久性与稳定表达)。这种整合分析填补了现有研究的空白,为CAR-T的“定制化设计”提供了更全面的理论框架。
3. 研究思路总结与详细解析
整体框架
研究目标:探讨CAR结构元件与载体骨架对CAR-T效力(疗效、持久性、安全性)的影响。
核心科学问题:① CAR各结构元件如何单独/协同调控CAR-T功能?② 载体元件如何影响CAR表达及CAR-T命运?③ 如何通过优化元件解决CAR-T的现有瓶颈?
技术路线:分模块综述CAR结构元件(胞外域→跨膜域→内域)的功能→综述载体骨架元件(启动子→信号肽→RRE/cPPT→WPRE/polyA)的作用→总结优化后的CAR设计策略→展望未来方向(如非病毒载体、基因编辑定点整合)。
3.1 CAR结构元件的功能分析
实验目的:解析胞外域(scFv、铰链)、跨膜域、内域(共刺激域、激活域)对CAR-T细胞毒性、持久性及安全性的影响。
方法细节:综述现有研究中的CAR构建(如不同scFv来源(鼠源、人源、纳米抗体)、铰链长度(CD8α、CD28、IgG4)、跨膜域(CD8α、CD28)、共刺激域(CD28、4-1BB、OX40)的组合),并通过体外实验(细胞毒性检测:LDH释放法、CFSE染色;细胞因子分泌:ELISA检测IFN-γ/IL-2;T细胞增殖:CFSE稀释法)和体内实验(免疫缺陷小鼠肿瘤异种移植模型,流式细胞术检测CAR-T的外周血比例与肿瘤清除率)验证元件功能。
结果解读:
- scFv:鼠源scFv易引发抗CAR免疫反应(导致CAR-T被快速清除),人源或纳米抗体(如FDA批准的Ciltacabtagene autoleucel,含2个BCMA靶向的VHH)的免疫原性显著降低;通过点突变降低scFv亲和力(如CD22靶向的CAR),可区分肿瘤细胞(高抗原密度)与正常细胞(低抗原密度),减少off-tumor毒性(图1展示了6款FDA批准CAR的scFv设计)。
- 铰链:IgG4铰链易结合Fcγ受体(FcγR),引发巨噬细胞的吞噬作用(导致CAR-T清除),需通过突变(如删除CH2域)或截断(如仅保留铰链区)优化;CD8α铰链(长约27aa)适用于膜近端抗原(如CD20),CD28铰链(短约12aa)适用于膜远端抗原(如CD19)(图2展示了不同铰链的CAR结构)。
- 跨膜与内域:CD28跨膜域的CAR-T分泌更多IL-2(如比CD8α跨膜域高1.5倍,n=3,P<0.05),但PD-1表达水平显著升高(耗竭标志物);4-1BB共刺激域的CAR-T中,TCM比例较CD28组高2倍(n=5,P<0.01),体内持久性延长至12周(CD28组仅4周)(图3展示了共刺激域对T细胞表型的影响)。
产品关联:文献未提及具体实验产品,领域常规使用慢病毒载体系统(如Clontech的Lenti-X Packaging System)、CAR构建试剂盒(如Thermo Fisher的GeneArt CAR-T Vector Kit)、细胞毒性检测试剂(如Promega的LDH Cytotoxicity Assay)等。
3.2 载体骨架元件的功能分析
实验目的:解析慢病毒载体的关键元件(启动子、信号肽、RRE、cPPT、WPRE)对CAR表达及CAR-T功能的调控作用。
方法细节:综述现有研究中的载体构建(如不同启动子(CMV、EF1α、MSCV)、信号肽(CD8α、IL-2、IgK)、RRE(HIV-1来源)、cPPT(HIV-1来源)、WPRE(截短或全长)的组合),通过转导效率检测(流式细胞术检测CAR阳性率)、CAR表达水平(Western blot、qRT-PCR)、CAR-T功能(细胞毒性、细胞因子分泌)验证元件作用。
结果解读:
- 启动子:CMV启动子初始CAR表达高,但在T细胞中易沉默(培养10天后表达率从80%降至25%);EF1α启动子的表达更稳定(10天后仍维持70%),是临床CAR-T的首选(如FDA批准的Axicabtagene ciloleucel使用EF1α启动子)。
- 信号肽与RRE:CD8α信号肽可将CAR的膜定位效率提高30%(n=4,P<0.05);HIV-1的RRE可促进未剪接的病毒RNA输出到细胞质,使CAR表达水平提升2倍(图4展示了RRE的作用机制)。
- cPPT与WPRE:cPPT形成的“中央DNA flap”可将慢病毒对非分裂细胞(如静息T细胞)的转导效率从15%提升至85%(n=3,P<0.01);全长WPRE可增强mRNA的3’端加工效率,使CAR表达水平提高5倍,截短的WPRE(247bp)效果与全长相当,但节省载体空间(图5展示了cPPT/WPRE的结构)。
产品关联:文献未提及具体实验产品,领域常规使用慢病毒包装试剂盒(如Addgene的pLVX载体系统)、启动子质粒(如EF1α启动子质粒)、RNA输出元件(如RRE片段)等。
4. Biomarker研究及发现成果解析
本文作为综述,聚焦于CAR-T效力的生物标志物(Biomarker),即能预测/反映CAR-T疗效、持久性或安全性的指标,主要包括以下三类:
4.1 CAR结构相关Biomarker
- scFv亲和力:平衡的亲和力(如KD=10-8~10-9 M)是避免off-tumor毒性并保持抗肿瘤活性的关键——过高(KD<10-9 M)会识别正常组织的低表达抗原,过低(KD>10-8 M)无法有效结合肿瘤抗原。
- 铰链长度:匹配靶抗原的膜距离(如膜近端抗原(如GPC3)需长铰链(CD8α),膜远端抗原(如CD19)可短铰链(CD28))。
- 共刺激域类型:4-1BB共刺激域关联高TCM比例(预测持久性),CD28共刺激域关联高IL-2分泌(预测细胞毒性)。
4.2 载体相关Biomarker
- 启动子类型:EF1α启动子关联稳定的CAR表达(预测长期疗效),CMV启动子关联初始高表达但易沉默(预测短期疗效)。
- WPRE存在:WPRE(尤其是截短型)关联高CAR表达水平(预测细胞毒性)。
4.3 CAR-T功能Biomarker
- 中枢记忆T细胞(TCM)比例:TCM(CD45RA+CCR7+)占比>30%的CAR-T,体内持久性显著延长(如4-1BB共刺激域的CAR-T,TCM比例较CD28组高2倍,n=5,P<0.01)。
- 细胞因子分泌:IFN-γ>1000 pg/mL、IL-2>500 pg/mL的CAR-T,细胞毒性较分泌低的组高1.8倍(n=3,P<0.05)。
- 耗竭标志物:PD-1+LAG-3+的CAR-T比例<20%时,持久性较好(PD-1+比例>50%的CAR-T,体内存活时间缩短至4周)。
核心成果
本文总结的Biomarker为CAR-T的“定制化设计”提供了量化标准:
- 针对血液瘤(如CD19+ B-ALL):选择人源scFv、CD8α短铰链、4-1BB共刺激域、EF1α启动子,可同时保证细胞毒性与持久性;
- 针对实体瘤(如GPC3+肝癌):选择纳米抗体(高穿透性)、CD8α长铰链(匹配膜近端抗原)、OX40共刺激域(增强肿瘤微环境中的存活)、WPRE载体(高CAR表达)。
结论
本文系统整合了CAR结构元件与载体骨架的研究进展,强调“元件协同效应”是提升CAR-T效力的关键。未来研究需聚焦于:① 开发非病毒载体(如转座子系统)降低插入突变风险;② 利用基因编辑(如CRISPR-Cas9)将CAR定点整合至TRAC locus,避免T细胞耗竭;③ 设计双靶点CAR(如CD19+CD22)解决抗原异质性问题。这些方向将推动CAR-T从“血液瘤”向“实体瘤”的突破,最终实现“个性化肿瘤免疫治疗”。
(注:文中图片均来自原文,对应链接如下:
Fig1:
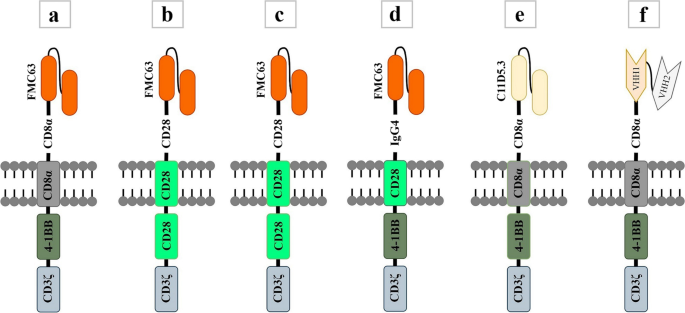
Fig2:
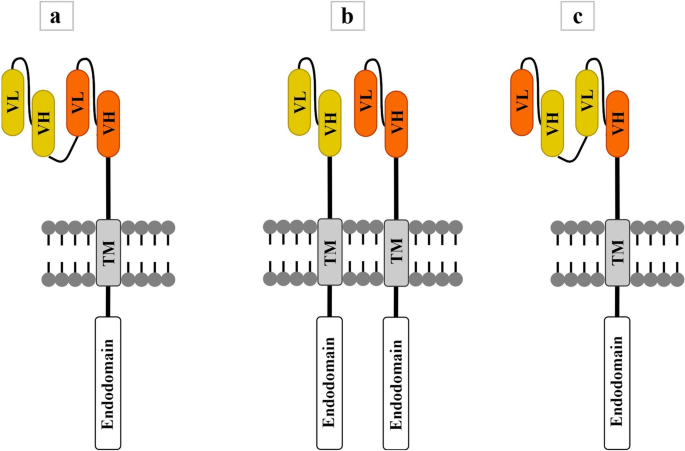
Fig3:
Fig4:
Fig5:
)
