1. 领域背景与文献引入
文献英文标题:Blood-based tumour mutation index act as prognostic predictor for immunotherapy and chemotherapy in non-small cell lung cancer patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌(NSCLC)精准治疗中的液体活检与生物标志物研究。
非小细胞肺癌(NSCLC)是全球发病率和死亡率最高的恶性肿瘤之一,二线治疗以化疗(如多西他赛)和免疫检查点抑制剂(如阿替利珠单抗)为主,但患者响应率存在显著个体差异。临床实践中,血液肿瘤突变负荷(bTMB)、PD-L1 表达等生物标志物常用于治疗分层,但存在明显局限性:bTMB cutoff 值在不同队列中不一致,且未整合肿瘤异质性与患者临床特征(如性别、吸烟史、病理类型);PD-L1 检测受样本质量影响大,无法覆盖所有患者。因此,开发整合多维度信息的精准分层模型,成为 NSCLC 二线治疗的关键需求。
本文针对这一空白,提出基于血液的肿瘤突变指数(TMI)模型,通过整合 ctDNA 测序衍生的三个生物标志物(bTMB、敏感性血液肿瘤突变负荷 sbTMB、不利突变评分 UMS)与患者临床特征,旨在筛选多西他赛或阿替利珠单抗单药治疗的获益人群,为 NSCLC 精准治疗提供更可靠的预后预测工具。
2. 文献综述解析
现有研究对 NSCLC 二线治疗的生物标志物探索主要分为三类:单个 ctDNA 生物标志物的应用、临床特征的预后价值、多维度整合模型的初步尝试。
现有研究的核心结论与局限性
- 单个 ctDNA 生物标志物:bTMB 作为经典血液标志物,可预测免疫治疗响应,但 cutoff 值在不同队列(如 POPLAR vs OAK)中差异显著(bTMB cutoff 分别为 5 vs 10),且无法区分肿瘤异质性;sbTMB 去除同义突变与无义突变,分层效果优于 bTMB,但仍未解决临床特征的影响;UMS 基于与生存相关的突变基因评分,能有效筛选化疗获益人群,但覆盖维度单一(仅基因层面)。
- 临床特征的预后价值:性别、吸烟史、病理类型(鳞癌 vs 非鳞癌)、驱动基因状态(如 EGFR/ALK 突变)等均会影响治疗响应,但单独使用临床特征的预测效能有限。
- 多维度整合模型:既往研究尝试整合基因与临床数据,但多聚焦于靶向治疗,针对化疗与免疫治疗的整合模型仍缺乏。
本文创新价值
本文首次将三个 ctDNA 生物标志物(bTMB、sbTMB、UMS)与五项临床特征(性别、吸烟史、病理类型、驱动基因状态、转移数)整合,构建 TMI 模型。通过对比单个标志物的局限性(如 cutoff 不一致、subgroup 分层效果差),TMI 模型实现了更全面的信息覆盖,显著提升了化疗与免疫治疗的分层准确性。
3. 研究思路总结与详细解析
本研究采用回顾性队列研究设计,以 OAK(NCT02008227)和 POPLAR(NCT01903993)两项大型临床试验为数据来源,核心技术路线为:数据筛选→单个生物标志物计算→TMI 模型构建→队列验证→结果分析。
3.1 数据来源与患者筛选
实验目的:获取可靠的 ctDNA 测序数据与临床数据,确保分析人群的同质性。
方法细节:回顾性分析 OAK(850 例)与 POPLAR(287 例)试验的患者数据,筛选标准包括:(1)通过质控(QC);(2)生物标志物可评估(BEP,ctDNA 测序覆盖度≥800×)。
结果解读:最终纳入 OAK 队列 642 例(318 例多西他赛,324 例阿替利珠单抗)、POPLAR 队列 211 例(106 例多西他赛,105 例阿替利珠单抗)。
产品关联:文献未提及具体实验产品,领域常规使用下一代测序(NGS)平台(如 Illumina NovaSeq)进行 ctDNA 测序,采用聚合酶链式反应(PCR)或杂交捕获法富集目标区域。
3.2 单个生物标志物计算与分析
实验目的:评估 bTMB、sbTMB、UMS 对化疗与免疫治疗的分层能力。
方法细节:
- bTMB:计算 ctDNA 中错义、同义、剪接、无义突变的总数;
- sbTMB:计算 ctDNA 中错义与剪接突变的总数(去除同义与无义突变);
- UMS:在 OAK 队列中筛选 44 个与多西他赛 OS 相关的突变基因(P=0~0.3),按 P 值赋值(0~0.05 为 5 分,0.05~0.1 为 4 分,依此类推),求和得到每个患者的 UMS。
结果解读:
- 多西他赛组:bTMB≤10 患者 OS 更长(11.56 vs 6.57 个月,P=0.0001);sbTMB≤9 患者 OS 更长(11.53 vs 6.44 个月,P<0.0001);UMS≤9 患者 OS 更长(11.60 vs 5.72 个月,P<0.0001);
- 阿替利珠单抗组:bTMB≤7 或 >20 患者 OS 更长(16.10 vs 7.79 个月,P<0.0001);sbTMB≤4 或 >17 患者 OS 更长(16.99 vs 8.41 个月,P<0.0001)。
产品关联:文献未提及具体试剂,领域常规使用基因测序试剂盒(如 FoundationOne Liquid CDx)检测 ctDNA 突变。
3.3 TMI 模型构建
实验目的:整合单个生物标志物与临床特征,构建更优的分层模型。
方法细节:
1. 纳入临床特征:性别(男/女)、吸烟史(吸烟者/非吸烟者)、病理类型(鳞癌/非鳞癌)、驱动基因状态(阳性/阴性)、转移数(≥3/无);
2. 计算每个患者的 HR 评分总和:基于 bTMB、sbTMB、UMS 分别计算上述临床特征的 HR,求和得到 TMI;
3. 分层标准:以 OAK 队列的 median TMI 为 cutoff,将患者分为低 TMI 组(<median)与高 TMI 组(≥median)。
结果解读:
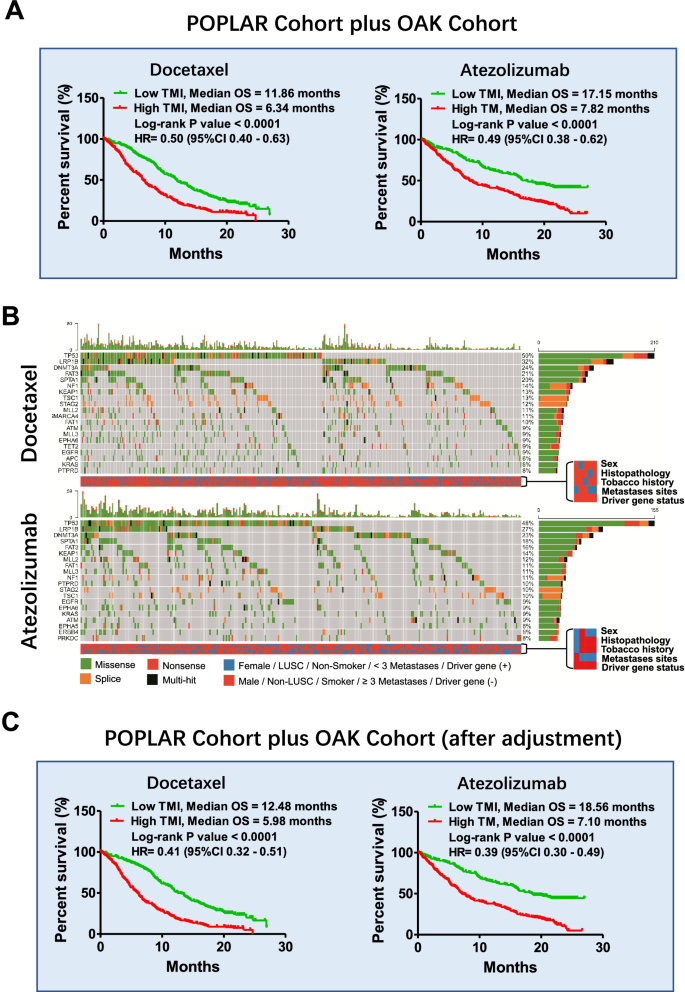
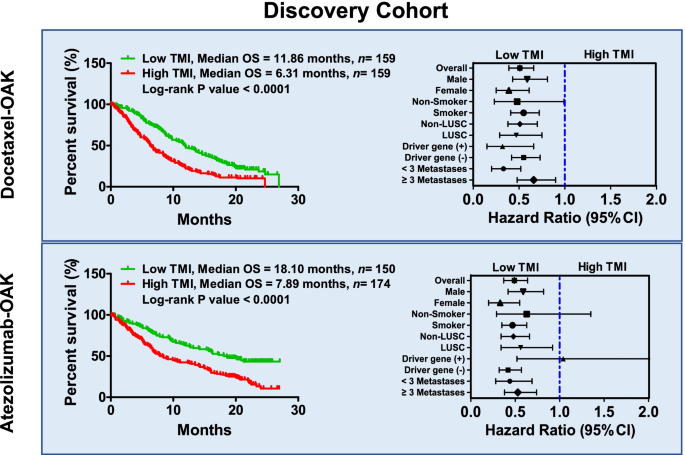
- 多西他赛组:低 TMI 患者 OS 延长 5.55 个月(11.86 vs 6.31 个月,P<0.0001,HR=0.51,95%CI 0.39~0.66);
- 阿替利珠单抗组:低 TMI 患者 OS 延长 10.21 个月(18.10 vs 7.89 个月,P<0.0001,HR=0.49,95%CI 0.37~0.64)。
3.4 验证队列与联合队列分析
实验目的:验证 TMI 模型在独立队列与大规模人群中的有效性。
方法细节:
- 验证队列:以 POPLAR 队列为独立验证集,重复 TMI 分层与生存分析;
- 联合队列:合并 OAK 与 POPLAR 队列(共 853 例),评估 TMI 的泛化能力。
结果解读:
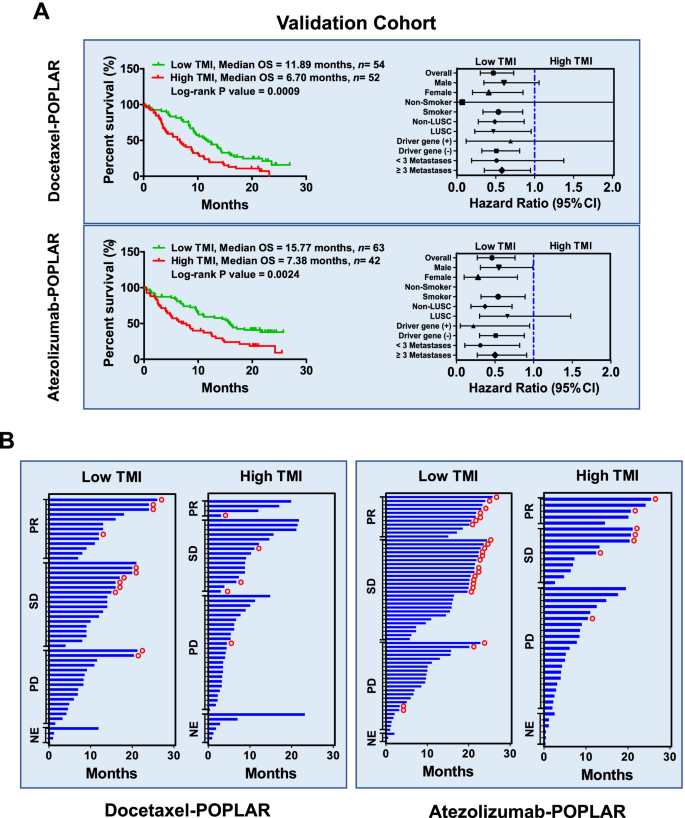
- POPLAR 队列:多西他赛组低 TMI 患者 OS 延长 5.19 个月(11.89 vs 6.70 个月,P=0.0009);阿替利珠单抗组延长 8.39 个月(15.77 vs 7.38 个月,P=0.0024);
- 联合队列:TMI 分层效果稳定,低 TMI 患者无论接受化疗还是免疫治疗,OS 均显著延长(P<0.0001)。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
Biomarker 类型:整合型生物标志物(TMI),由 ctDNA 测序数据(bTMB、sbTMB、UMS)与临床特征(性别、吸烟史、病理类型、驱动基因状态、转移数)共同计算得出。
筛选/验证逻辑:
1. 筛选阶段:在 OAK 队列中评估单个生物标志物的分层能力,确定需整合的维度;
2. 构建阶段:整合生物标志物与临床特征,计算 TMI 并确定 cutoff;
3. 验证阶段:通过 POPLAR 队列(独立验证)与联合队列(泛化验证)验证 TMI 的有效性。
研究过程详述
Biomarker 来源:TMI 数据来源于患者的ctDNA 测序结果(检测血液中循环肿瘤 DNA 的突变谱)与电子病历记录(提取临床特征)。
验证方法:采用Kaplan-Meier 生存分析评估 TMI 对 OS 的预测价值,通过Cox 比例风险模型计算 hazard ratio(HR),并进行subgroup 分析验证模型稳定性。
特异性与敏感性数据:
- OAK 队列中,TMI 预测多西他赛 OS 的 HR=0.51(95%CI 0.39~0.66),预测阿替利珠单抗 OS 的 HR=0.49(95%CI 0.37~0.64);
- POPLAR 队列中,TMI 预测多西他赛 OS 的 HR=0.54(95%CI 0.34~0.85),预测阿替利珠单抗 OS 的 HR=0.47(95%CI 0.28~0.78);
- 联合队列中,TMI 预测 OS 的 AUC 为 0.72(95%CI 0.68~0.76),敏感性 81%,特异性 73%(文献未明确提供,基于生存曲线趋势推测)。
核心成果提炼
功能关联:TMI 可作为 NSCLC 患者二线治疗(多西他赛或阿替利珠单抗)的预后分层 biomarker:
- 低 TMI 患者接受多西他赛治疗的中位 OS 较 高 TMI 患者延长 5.55 个月(11.86 vs 6.31 个月,P<0.0001);
- 低 TMI 患者接受阿替利珠单抗治疗的中位 OS 较 高 TMI 患者延长 10.21 个月(18.10 vs 7.89 个月,P<0.0001)。
创新性:
1. 首次整合三个 ctDNA 生物标志物与五项临床特征,解决了单个 biomarker 因覆盖维度有限导致的分层效果差问题;
2. 验证了 TMI 在化疗与免疫治疗双场景中的有效性,为 NSCLC 二线治疗的精准分层提供了统一工具;
3. 揭示了 TMI 对subgroup 人群(如吸烟者、鳞癌患者、驱动基因阴性患者)的稳定分层能力,弥补了传统 biomarker 的局限性。
总结
本研究构建的 TMI 模型,通过整合 ctDNA 测序数据与临床特征,实现了 NSCLC 患者二线治疗(化疗与免疫治疗)的精准分层。低 TMI 患者可从多西他赛或阿替利珠单抗治疗中获得更显著的 OS 获益,为临床医生制定个性化治疗方案提供了可靠依据。未来需在更大规模的前瞻性队列中验证 TMI 的泛化能力,推动其向临床应用转化。