1. 领域背景与文献引入
文献英文标题:SGOL2 is a novel prognostic marker and fosters disease progression via a MAD2-mediated pathway in hepatocellular carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝细胞癌(HCC)生物标志物与分子机制。
肝细胞癌是全球第三大癌症相关死亡原因,尽管手术切除、靶向治疗等手段取得进步,但晚期患者5年生存率仍不足20%,核心瓶颈在于缺乏早期诊断标志物及精准治疗靶点。Shugoshin家族蛋白(SGOL1、SGOL2)是维持着丝粒 cohesion、确保有丝分裂正确进行的关键因子——SGOL1已被证实在HCC中异常上调并与早期癌变相关,但SGOL2在HCC中的功能及机制尚未明确。此外,SGOL2与纺锤体组装 checkpoint(SAC)核心蛋白MAD2的相互作用已在有丝分裂研究中报道,但二者在HCC中的功能关联仍是空白。针对这一研究缺口,本文系统探索SGOL2在HCC中的表达模式、预后价值及通过MAD2调控细胞周期的分子机制,为HCC的精准诊疗提供新靶点。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“SGOL家族功能→SGOL2与MAD2的相互作用→HCC中的未知领域”展开:
现有研究明确SGOL1在HCC中高表达,通过AKT通路促进增殖转移,但SGOL2在HCC中的表达及作用未被探讨;SGOL2作为centromeric蛋白,可与MAD2结合形成复合物,调控姐妹染色单体分离,但这一机制在HCC中的病理意义未知;部分研究提示SGOL2在其他癌症(如肾上腺皮质癌)中与不良预后相关,但未涉及HCC。
对比现有研究,本文的创新点体现在三方面:首次通过两个独立临床队列验证SGOL2在HCC中的高表达及不良预后价值;首次揭示SGOL2与MAD2在HCC细胞中的直接相互作用;首次系统阐明SGOL2通过MAD2调控细胞周期(cyclin D1/cyclin E1通路)促进HCC进展的分子机制,弥补了SGOL2在HCC研究中的空白。
3. 研究思路总结与详细解析
3.1 临床样本中SGOL2的表达及预后分析
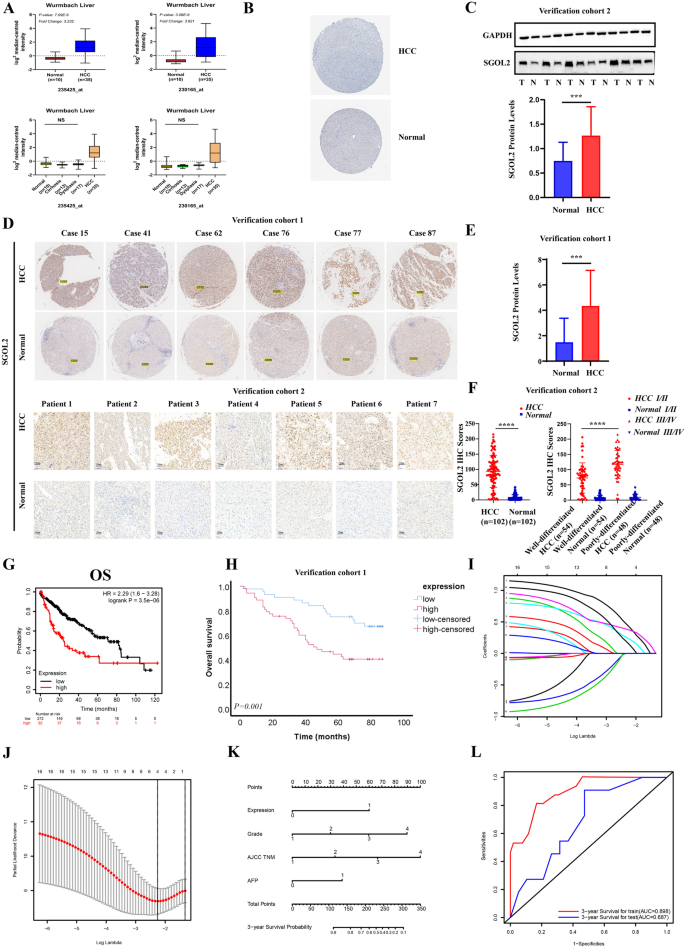
实验目的:验证SGOL2在HCC组织中的表达差异及与临床预后的关联。
方法细节:收集两个临床队列(队列1:97对匹配HCC及癌旁组织+3例单发HCC;队列2:102对匹配样本),采用免疫组化(IHC)检测蛋白表达,Western blot验证队列2中SGOL2的差异;结合TCGA数据库分析SGOL2 mRNA与临床病理特征(肿瘤分级、分期)及预后(总生存期OS、无复发生存期RFS)的关联;通过LASSO回归构建SGOL2为核心的nomogram预后模型。
结果解读:HCC组织中SGOL2 mRNA(TCGA,371例肿瘤vs 50例正常,P<0.05)及蛋白(队列1/2,免疫组化评分,P<0.01)水平显著高于癌旁组织;SGOL2高表达与肿瘤高分级(队列1,Grade 3 vs Grade 1/2,P=0.001)、晚期分期(TCGA,P<0.05)相关;TCGA中SGOL2高表达患者OS(HR=2.29,P=3.5e-06)、RFS(HR=1.96,P=0.00013)显著缩短;临床队列1中高表达组OS更短(p=0.001);nomogram模型训练集AUC=0.898,验证集AUC=0.687,提示良好的预后预测能力。
产品关联:免疫组化用SGOL2抗体(Abcam,ab122258);Western blot用SGOL2抗体(Bethyl,A301–262A)、GAPDH抗体(CST,5174)。
3.2 细胞模型中SGOL2的功能验证
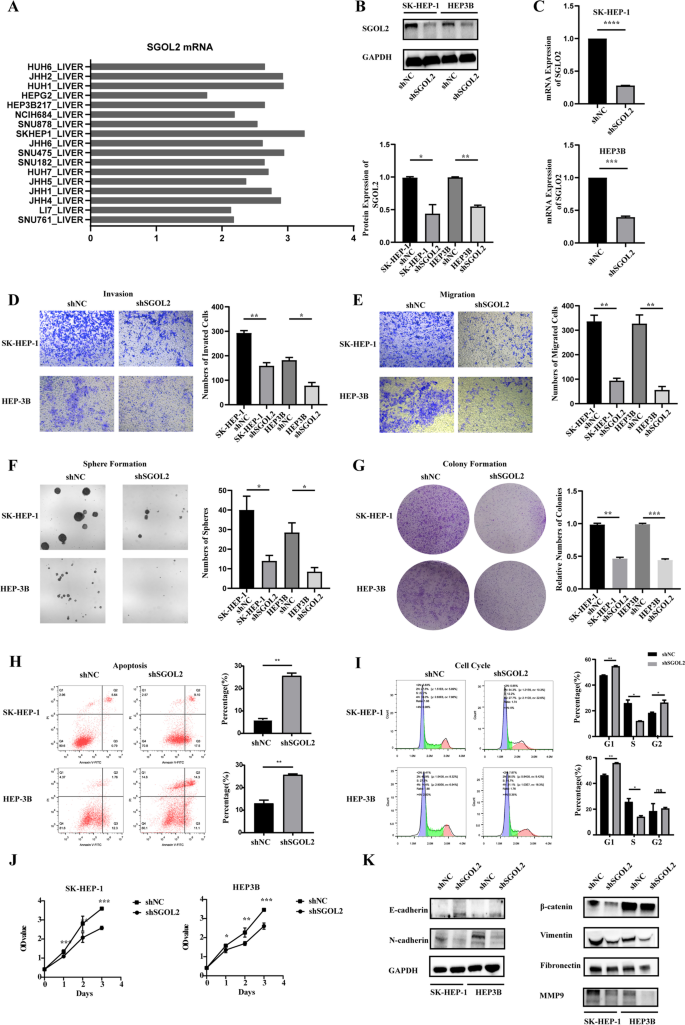
实验目的:明确SGOL2对HCC细胞增殖、迁移、侵袭的调控作用。
方法细节:根据CCLE数据库筛选SGOL2 mRNA高表达的SK-HEP-1、HEP3B细胞,通过慢病毒转染构建SGOL2敲低(shSGOL2)及对照组(shNC);采用Transwell实验检测迁移/侵袭能力,CCK-8法检测增殖,克隆形成/肿瘤球实验检测干细胞性,流式细胞术分析细胞周期(PI染色)及凋亡(Annexin V-FITC/PI),Western blot检测EMT标志物(E-cadherin、N-cadherin)。
结果解读:敲低SGOL2后,Transwell实验显示迁移细胞数减少60%(SK-HEP-1,n=3,P<0.01)、侵袭细胞数减少50%(HEP3B,n=3,P<0.01);CCK-8实验显示第3天细胞活力下降40%(P<0.01);克隆形成率降低50%(P<0.01)、肿瘤球数量减少60%(P<0.01);细胞周期阻滞于G1/S期(G1期比例从45%升至65%,n=3,P<0.01),凋亡率升高3倍(P<0.001);EMT标志物E-cadherin上调2倍,N-cadherin、vimentin下调50%(P<0.01)。
产品关联:慢病毒来自上海吉凯基因;Transwell小室(Corning);CCK-8试剂盒(APExBIO);流式检测用BD Annexin V-FITC/PI试剂盒;Western blot用E-cadherin(CST,14472)、N-cadherin(CST,13116)抗体。
3.3 SGOL2与MAD2的相互作用及机制研究
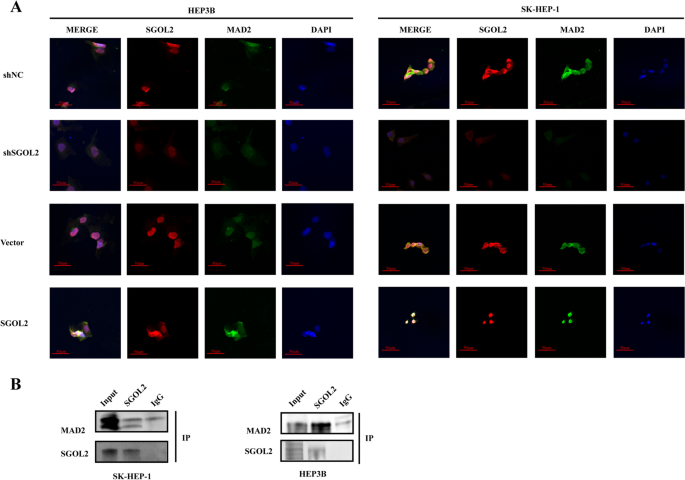
实验目的:验证SGOL2与MAD2的结合及对细胞周期的调控作用。
方法细节:采用免疫荧光(Confocal显微镜)观察SGOL2与MAD2的亚细胞定位;Co-IP实验验证二者内源性相互作用;Western blot检测敲低/过表达SGOL2后MAD2及细胞周期蛋白(PCNA、cyclin D1、cyclin E1)的表达;用MAD2特异性抑制剂M2I-1处理过表达SGOL2的细胞,检测迁移/侵袭能力;rescue实验(shSGOL2+MAD2过表达)验证MAD2的介导作用。
结果解读:免疫荧光显示SGOL2(红色)与MAD2(绿色)在细胞核内共定位(黄色荧光,图5A);Co-IP实验证实SGOL2可捕获MAD2(图5B);敲低SGOL2后,MAD2、PCNA、cyclin D1表达降低50%(P<0.01),过表达SGOL2则升高2倍(P<0.01);M2I-1处理逆转了过表达SGOL2引起的迁移能力增强(减少40%,P<0.01);rescue实验显示,过表达MAD2可恢复敲低SGOL2导致的增殖(CCK-8 OD值从0.4升至0.8,n=3,P<0.01)、迁移(细胞数从50增加至150,P<0.01)能力。
产品关联:Co-IP用Absin IP/COIP试剂盒;免疫荧光用SGOL2(Abcam,ab122258)、MAD2(Santa Cruz,C-10)抗体;抑制剂M2I-1(Sigma);Western blot用PCNA(CST,13110)、cyclin D1(CST,55506)抗体。

3.4 动物模型中SGOL2的功能验证
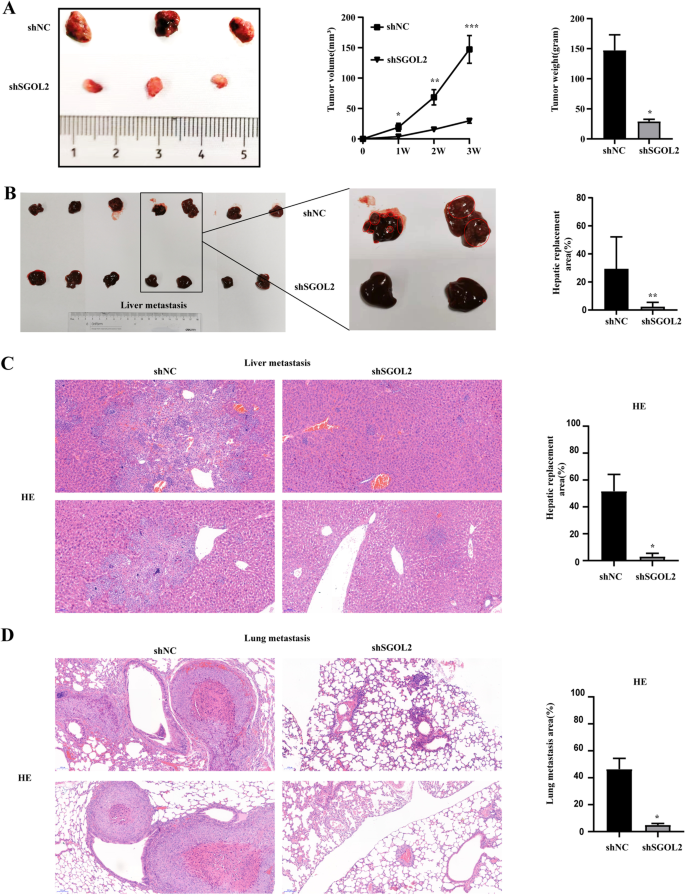
实验目的:验证SGOL2对HCC体内生长及转移的影响。
方法细节:构建裸鼠异种移植模型(皮下注射SK-HEP-1 shNC/shSGOL2细胞,n=3)及肺转移模型(尾静脉注射,n=7);定期测量肿瘤体积(公式:ab²/2),处死后代检测肿瘤重量;HE染色分析肺/肝转移面积;免疫组化检测肿瘤组织中增殖(Ki-67、PCNA)、血管生成(CD34)、EMT(E-cadherin、N-cadherin)及凋亡(TUNEL)标志物。
结果解读:敲低SGOL2组肿瘤体积(从1000 mm³降至300 mm³,n=3,P<0.01)、重量(从1.2 g降至0.4 g,P<0.01)显著小于对照组;肺转移面积减少70%(HE染色,P<0.01),肝转移面积减少60%(P<0.01);肿瘤组织中Ki-67(从50%降至20%,P<0.01)、PCNA(从40%降至15%,P<0.01)、CD34(血管密度从30/HPF降至10/HPF,P<0.01)表达下调,E-cadherin(从10%升至40%,P<0.01)表达上调,凋亡面积增加3倍(TUNEL,P<0.001)。
产品关联:裸鼠来自浙江医学科学院;HE染色试剂盒(Solarbio);免疫组化用Ki-67(CST)、CD34(Abcam)、TUNEL试剂盒(Vazyme,A112-03)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选验证逻辑
SGOL2是HCC的预后生物标志物,筛选验证遵循“数据库挖掘→临床队列验证→功能机制验证”的完整链条:
1. 数据库筛选:TCGA数据库分析显示SGOL2在HCC中高表达(371例肿瘤vs 50例正常,P<0.05),且与不良预后相关(HR=2.29,P=3.5e-06);
2. 临床验证:两个独立队列(共202例HCC样本)通过免疫组化、Western blot证实SGOL2高表达(P<0.01),且高表达组OS更短(队列1,p=0.001);
3. 功能验证:细胞/动物实验证实SGOL2通过MAD2调控细胞周期,促进增殖转移,明确其病理功能。
4.2 研究过程与核心数据
- 来源:临床HCC组织样本(队列1/2)、TCGA数据库;
- 验证方法:免疫组化(蛋白水平)、qRT-PCR(mRNA水平)、nomogram模型(预后预测);
- 特异性与敏感性:TCGA中SGOL2高表达预测不良OS的HR=2.29(95% CI 1.6-3.28),队列1中高表达组OS中位数比低表达组短18个月(36个月vs 54个月,p=0.001);nomogram模型训练集AUC=0.898(95% CI 0.85-0.94),验证集AUC=0.687(95% CI 0.58-0.79),提示良好的预后区分能力。
4.3 成果与创新性
SGOL2作为HCC预后标志物的核心价值:
- 功能关联:SGOL2高表达通过与MAD2形成复合物,上调cyclin D1/cyclin E1,促进细胞周期进展,最终增强HCC增殖、迁移、侵袭能力;
- 创新性:首次在HCC中证实SGOL2的预后价值,且其机制依赖MAD2介导的细胞周期调控;
- 临床意义:nomogram模型(整合SGOL2、肿瘤分级、TNM分期、AFP)可有效预测HCC患者3年OS,为临床预后评估提供工具;SGOL2-MAD2通路可作为HCC的潜在治疗靶点(如MAD2抑制剂M2I-1可逆转SGOL2的促癌作用)。
综上,本文系统阐明了SGOL2在HCC中的表达模式、预后价值及分子机制,为HCC的精准诊疗提供了新的生物标志物及治疗靶点,具有重要的临床转化潜力。
