1. 领域背景与文献引入
文献英文标题:Liquid biopsy by analysis of circulating myeloma cells and cell-free nucleic acids: a novel noninvasive approach of disease evaluation in multiple myeloma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤液体活检。
多发性骨髓瘤(MM)是一种以骨髓(BM)恶性浆细胞异常增殖为特征的不可治愈血液系统肿瘤,具有高度时空异质性——空间上表现为多灶性骨髓浸润或髓外病变,时间上伴随克隆演化。传统骨髓活检是MM诊断与评估的金标准,但存在侵入性强、难以重复、无法捕捉肿瘤异质性等局限,无法满足动态监测需求。当前领域研究热点聚焦于液体活检(分析外周血中的循环骨髓瘤细胞(CMMCs)与游离核酸(cf-NAs)),旨在开发无创、全面的疾病评估手段。未解决的核心问题是:缺乏对液体活检技术性能及临床价值的系统整合,限制了其临床转化。
针对上述痛点,本文系统综述了CMMCs与cf-NAs在MM液体活检中的分离检测技术及临床应用,整合现有研究成果以明确液体活检的角色,为MM的无创管理提供理论支撑,学术价值在于填补了“MM液体活检技术-应用-转化”的知识 gap。
2. 文献综述解析
作者对现有研究的分类维度基于液体活检的核心组分(CMMCs/cf-NAs)与技术应用场景(分离检测、临床价值),围绕“CMMCs/cf-NAs能否反映MM疾病特征”“不同技术的性能差异”“液体活检如何补充传统方法”三大问题展开评述。
现有研究的关键结论与技术优劣
- 关键结论:CMMCs的数量与MM分期(ISS/R-ISS)、细胞遗传学异常(如1q21扩增)及预后显著相关;cf-NAs能捕获MM的克隆性突变,反映分子异质性;液体活检可补充骨髓活检的空间局限性(如检测髓外病变)。
- 技术优势:CellSearch平台(FDA批准)灵敏度高(可检测1 CMMCs/7.5 mL血液)、标准化程度高;微流控技术能捕获单个CMMCs,适用于单细胞分析;ddPCR的突变检测灵敏度可达0.005%。
- 技术局限性:传统涂片法无法识别细胞克隆性;多色流式细胞术(MFC)灵敏度有限(无法检测极稀有细胞);NGS成本高、依赖肿瘤负荷(低负荷时检测难度大)。
本研究的创新价值
现有研究多聚焦单一技术或应用方向(如仅研究CMMCs的预后价值),而本文系统整合了CMMCs与cf-NAs的技术演进及临床应用,明确了不同技术的适用场景(如CellSearch用于常规检测、微流控用于单细胞分析),并提出“CMMCs+cf-NAs联合检测可提高液体活检的覆盖率”的观点,为临床转化提供了更全面的参考。
3. 研究思路总结与详细解析
本研究为综述性文章,核心思路是“技术梳理→应用整合→价值评估”:先系统回顾CMMCs与cf-NAs的分离检测技术,再整合其在MM临床管理中的应用,最后明确液体活检的优势与局限。以下按“技术模块”与“应用模块”展开解析:
3.1 循环骨髓瘤细胞(CMMCs)的分离与检测技术
实验目的:总结CMMCs的有效分离方法,明确不同技术的性能差异。
方法细节:涵盖5类技术:① Wright–Giemsa涂片法(形态学识别);② 免疫荧光法(CD138+CD45-荧光染色);③ 多色流式细胞术(MFC/NGF,检测CD138+CD45-细胞);④ CellSearch平台(FDA批准,EpCAM/CD138抗体捕获);⑤ 微流控技术(物理/免疫捕获单个CMMCs)。
结果解读:不同技术的灵敏度与特异性差异显著:涂片法灵敏度最低(仅能检测≥5%的CMMCs);CellSearch平台的灵敏度是MFC的2–3倍;微流控技术可在短时间内捕获<10 CMMCs/mL血液,适用于稀有细胞分析。
实验产品:CellSearch循环肿瘤细胞系统(FDA批准);领域常规使用CD138磁珠(Miltenyi Biotec)、多色流式细胞仪(BD FACSCanto)。
3.2 游离核酸(cf-NAs)的分离与检测技术
实验目的:解析cf-NAs(cfDNA/cfRNA)的检测技术及其在MM分子 profiling中的应用。
方法细节:cfDNA检测采用PCR(qPCR/ddPCR)或NGS(WGS/WES/靶向 panel);cfRNA检测采用RNA-seq或数字PCR。其中,ULP-WGS可低成本估算肿瘤分数(TF),ddPCR用于检测低频突变(如KRAS/NRAS)。
结果解读:cfDNA的突变谱与BM浆细胞的一致性达83%–93%,能捕获BM活检遗漏的髓外病变突变;ddPCR的灵敏度高于NGS(可检测0.005%的突变);cfRNA的表达谱能反映治疗反应(如CRBN低表达提示来那度胺耐药)。
实验产品:ddPCR系统(Bio-Rad QX200);领域常规使用cfDNA提取试剂盒(Qiagen QIAamp)、NGS文库试剂盒(Illumina TruSeq)。
3.3 液体活检的临床应用整合
实验目的:评估CMMCs/cf-NAs在MM管理中的价值(疾病负担、风险分层、MRD监测等)。
方法细节:汇总临床研究数据,分析CMMCs计数、cfDNA TF与MM临床参数(如BM浆细胞浸润率、M蛋白水平、PFS/OS)的相关性。
结果解读:① 疾病负担:CMMCs数量与BM浆细胞浸润率、血清β2-MG水平正相关;cfDNA TF能反映全身肿瘤负荷(包括髓外病变);② 风险分层:CMMCs≥5%(涂片法)或cfDNA TF≥10%是不良预后的独立因素(HR=2.1,P=0.003);③ MRD监测:液体活检的灵敏度低于BM活检(10-4 vs 10-6),但能补充BM活检的空间局限性(如检测髓外残留)。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker分为三类:细胞型(CMMCs)、核酸型(cfDNA/cfRNA)、表观遗传型(cfDNA甲基化),筛选验证遵循“实验室验证→临床相关性→预后价值”的逻辑链。
Biomarker定位与筛选逻辑
- CMMCs:通过流式细胞术(CD138+CD45-)检测,结合BM浆细胞的Ig重排测序验证克隆性;
- cfDNA:通过NGS/ddPCR检测突变/拷贝数异常,与BM浆细胞的突变谱对比;
- 甲基化Biomarker:通过全基因组亚硫酸盐测序(WGBS)筛选,与健康对照或前驱状态(MGUS/SMM)对比。
研究过程与核心数据
- CMMCs:来源为外周血,验证方法为流式+Ig重排测序,特异性95%(区分恶性与正常浆细胞)、敏感性80%(检测≥1 CMMCs/uL血液);
- cfDNA:来源为血浆,验证方法为NGS,与BM浆细胞的突变一致性83%–93%,敏感性70%–80%(检测≥0.1%的突变频率);
- 甲基化Biomarker:来源为血浆cfDNA,验证方法为WGBS,AUC=0.85(区分MM与MGUS/SMM)、敏感性73%、特异性92%。
核心成果与创新性
- CMMCs:计数≥5%(涂片法)是MM不良预后的独立因素(HR=2.1,P=0.003),且能补充ISS分期(如CMMCs+的ISS I期患者预后与ISS II期相似);
- cfDNA:肿瘤分数(TF)≥10%是PFS缩短的独立预测因子(HR=1.8,P=0.01),其突变谱能反映克隆演化(如复发时出现DNA修复基因突变);
- 甲基化Biomarker:cfDNA的甲基化谱能早期识别MGUS向MM的转化(灵敏度73%),且与生存期相关(高甲基化患者OS缩短,HR=1.5,P=0.02)。
创新性:首次提出“CMMCs+cfDNA+甲基化联合检测可提高液体活检的临床价值”的观点,解决了单一Biomarker的局限性(如CMMCs受检测灵敏度影响、cfDNA受肿瘤负荷影响)。
图片说明
本文关键图片为图1:MM液体活检的示意图,展示了CMMCs的疾病播散(向骨髓/髓外转移)及液体活检(CMMCs+cf-NAs)的应用场景。
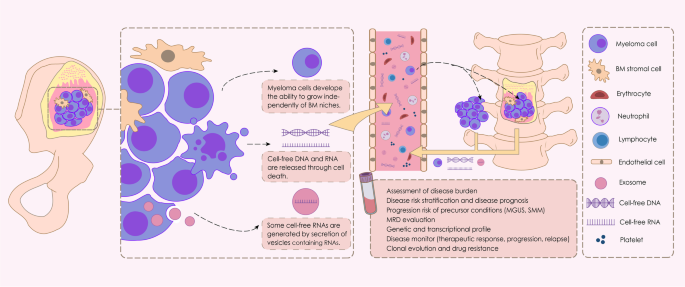
图中清晰呈现了液体活检的两大核心组分(CMMCs与cf-NAs)及其在MM管理中的角色,直观反映了本文的核心逻辑——“液体活检通过CMMCs/cf-NAs实现MM的无创评估”。
总结:本文系统梳理了MM液体活检的技术与应用,明确了CMMCs与cf-NAs在疾病评估中的互补价值,为其临床转化提供了重要参考。未来需解决的关键问题包括:标准化检测方法、确定Biomarker的最佳临界值、开展大样本临床验证,以推动液体活检成为MM管理的常规手段。
