1. 领域背景与文献引入
文献英文标题:c-MYB is a transcriptional regulator of ESPL1/Separase in BCR-ABL-positive chronic myeloid leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:慢性粒细胞白血病(CML)的转录调控与基因组稳定性。
慢性粒细胞白血病(CML)是由t(9;22)染色体易位形成BCR-ABL融合基因导致的造血干细胞克隆性疾病,其核心致病机制是BCR-ABL酪氨酸激酶的持续活化,驱动造血祖细胞异常增殖、抑制凋亡并阻断分化。伊马替尼作为BCR-ABL酪氨酸激酶抑制剂(TKI)是CML的一线治疗药物,显著改善了患者预后,但长期治疗后仍存在两大挑战:一是残留病灶难以清除,二是部分患者出现耐药或克隆演化(表现为染色体异常如8号染色体三体、17号染色体缺失),导致疾病进展为加速期(AP)或急变期(BC)。基因组不稳定性是CML进展的关键特征,而Separase(由ESPL1基因编码)是染色体分离和中心体复制的关键酶,其过表达或异常活化会导致染色体不分离、中心体扩增,进而促进基因组不稳定性。此前研究发现,伊马替尼治疗会降低CML细胞中Separase的蛋白水平,但转录层面的调控机制尚未明确。
c-MYB是一种转录因子,在BCR-ABL依赖的造血祖细胞转化和白血病发生中起核心作用:其表达受BCR-ABL上调,且白血病细胞对高c-MYB水平的依赖度显著高于正常造血细胞。此外,c-MYB可调控CyclinB1等细胞周期基因,影响G2/M期转换。鉴于伊马替尼会降低c-MYB表达,且c-MYB与Separase的蛋白水平变化同步,本研究旨在探讨c-MYB是否通过转录调控直接调控ESPL1/Separase的表达,从而解释伊马替尼相关的Separase下调机制,为CML的基因组稳定性调控提供新视角。
2. 文献综述解析
本文综述的核心逻辑围绕“Separase的功能与CML基因组不稳定性”“c-MYB的转录调控作用”两条主线展开,逐步引出研究空白与创新点:
首先,作者系统梳理了Separase的生物学功能——作为有丝分裂后期的关键酶,通过切割黏连蛋白(Cohesin)实现姐妹染色单体分离和中心体复制,其精准调控是维持染色体稳定性的前提;而Separase过表达或异常活化会导致染色体不分离、中心体扩增,进而促进基因组不稳定性,这在乳腺癌、胶质瘤等多种癌症中已被证实。
其次,作者聚焦CML的疾病特征:BCR-ABL驱动的克隆性造血异常是疾病起始的核心,而克隆演化(染色体异常积累)是疾病进展的关键,约30%慢性期(CP)患者会因克隆演化进展为AP/BC,且与不良预后相关。伊马替尼虽能抑制BCR-ABL激酶活性,但无法清除CML干细胞,残留病灶的存活和耐药是疾病复发的根源。
接着,作者阐述c-MYB在CML中的作用:c-MYB是BCR-ABL依赖的造血祖细胞转化的必需因子,其表达受BCR-ABL通过PI3K/Akt通路调控(增强蛋白稳定性);此外,c-MYB可直接调控CD34、c-Kit等造血干细胞标志物,以及CyclinB1等细胞周期基因,影响细胞增殖与分化。
最后,作者指出研究空白:此前研究发现伊马替尼会降低CML细胞中Separase的蛋白水平,但转录层面的调控机制未知;同时,c-MYB与Separase的表达变化同步,但二者是否存在直接调控关系尚未验证。基于此,本研究的创新点在于:首次证明c-MYB通过直接结合ESPL1启动子,转录调控Separase的表达,为伊马替尼下调Separase的机制提供了转录层面的解释。
3. 研究思路总结与详细解析
本研究的整体思路是:观察关联→验证调控→证明直接结合,即先通过伊马替尼处理实验观察c-MYB与ESPL1的表达相关性,再通过siRNA沉默验证调控关系,最后通过EMSA和ChIP证明直接结合。以下分三个关键实验环节解析:
3.1 伊马替尼处理对c-MYB和ESPL1表达的影响
实验目的:验证伊马替尼是否同时降低CML细胞中c-MYB和ESPL1的转录及蛋白水平,并明确其依赖BCR-ABL的特性。
方法细节:选取BCR-ABL阳性CML细胞系(LAMA-84、K562)和BCR-ABL阴性对照细胞系(U937),用治疗剂量伊马替尼处理24小时(LAMA-84、K562用≤2.5μM,U937用5μM);通过定量逆转录PCR(qRT-PCR)检测c-MYB和ESPL1的mRNA水平(以β-葡萄糖醛酸苷酶(Gus)为内参,用Qiagen QuantiTect引物试剂盒);通过Western blot检测c-MYB和Separase的蛋白水平(用Abcam的c-MYB单克隆抗体(ab45150,1:10000稀释),Santa Cruz的山羊抗兔HRP二抗,ChemiDoc XRS+系统成像,Image Lab软件密度分析,以Actin为内参)。
结果解读:CML细胞系中,伊马替尼处理后c-MYB和ESPL1的mRNA及蛋白水平均显著下降(LAMA-84:c-MYB蛋白下降25.7±9.6%,ESPL1 mRNA下降90±3.3%;K562:c-MYB蛋白下降37.1±9.6%,ESPL1 mRNA下降25.0±9.7%);而BCR-ABL阴性的U937细胞中,二者表达无显著变化(图1,表1)。这表明伊马替尼对c-MYB和ESPL1的下调依赖BCR-ABL的存在。
产品关联:实验所用关键产品包括Abcam的c-MYB单克隆抗体(货号ab45150)、Santa Cruz的山羊抗兔HRP conjugated抗体、BIO-RAD的ChemiDoc™ XRS+成像系统、Qiagen的RNeasy RNA提取试剂盒和QuantiTect引物试剂盒、Roche的LightCycler 480 qRT-PCR系统。
3.2 c-MYB沉默对ESPL1/Separase表达的影响
实验目的:验证c-MYB的下调是否直接导致ESPL1/Separase的表达降低。
方法细节:使用Qiagen的c-MYB特异性siRNA(FlexiTube GeneSolution GS4602)和阴性对照siRNA(AllStars Negative Control siRNA),通过Lonza Nucleofector系统(程序T016)转染CML细胞系BV-173和LAMA-84;转染后48小时,通过qRT-PCR检测c-MYB mRNA水平,Western blot检测c-MYB和Separase蛋白水平。
结果解读:转染c-MYB siRNA后,BV-173和LAMA-84细胞中c-MYB的mRNA水平显著降低(图3a、b左列),同时c-MYB和Separase的蛋白水平同步下降(图3a、b中、右列);阴性对照siRNA处理组无明显变化。这直接证明c-MYB是ESPL1/Separase的正调控因子。
产品关联:实验所用关键产品包括Qiagen的c-MYB siRNA(货号GS4602)和阴性对照siRNA、Lonza的Nucleofector转染系统(程序T016)。
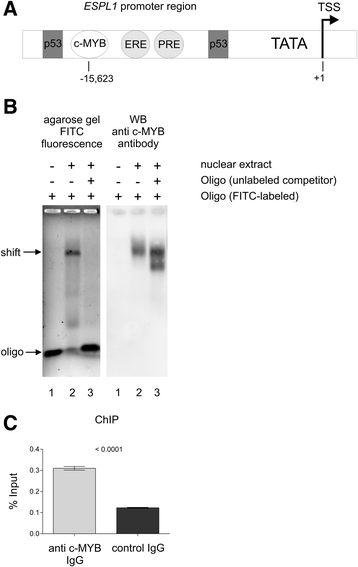
3.3 c-MYB与ESPL1启动子的直接结合验证
实验目的:证明c-MYB通过直接结合ESPL1启动子调控其转录。
方法细节:① 预测结合位点:通过SABiosciences的Champion ChIP转录因子搜索 portal,发现ESPL1启动子在转录起始位点(TSS)上游15623bp处存在一个c-MYB预测结合位点(53,646,460 - 53,646,470);② 体外结合验证(EMSA):制备BV-173细胞的核提取物,与FITC标记的ESPL1启动子c-MYB结合位点寡核苷酸孵育,电泳后检测DNA-蛋白复合物;同时进行竞争实验(加入100倍摩尔过量的未标记寡核苷酸);③ 体内结合验证(ChIP):使用Qiagen的EpiTect ChIP OneDay Kit,用Abcam的c-MYB抗体(ab17851)和对照IgG免疫沉淀BV-173细胞的染色质,qRT-PCR检测ESPL1启动子区域的富集情况。
结果解读:EMSA显示,核提取物与标记寡核苷酸形成滞后带(图4b lane2),而竞争实验中滞后带消失(图4b lane3),说明c-MYB特异性结合ESPL1启动子;Western blot验证滞后带中存在c-MYB(图4b右列)。ChIP结果显示,c-MYB抗体免疫沉淀的染色质中,ESPL1启动子区域的富集量显著高于对照IgG(图4c),直接证明c-MYB在体内结合ESPL1启动子。
产品关联:实验所用关键产品包括Sigma的FITC标记寡核苷酸、Abcam的c-MYB抗体(货号ab17851)、Qiagen的EpiTect ChIP OneDay Kit、BIO-RAD的Trans Blot SD半干转移系统。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker关联是:ESPL1/Separase作为CML基因组不稳定性的潜在Biomarker,其转录受c-MYB直接调控。筛选/验证逻辑为:① 细胞系与临床样本观察c-MYB与ESPL1的表达相关性;② siRNA沉默验证调控关系;③ EMSA/ChIP验证直接结合,形成完整的“关联-调控-结合”证据链。
研究过程详述
- Biomarker来源:ESPL1/Separase的检测样本包括CML细胞系(LAMA-84、K562、BV-173)和临床患者的外周血样本(5例配对样本:诊断时vs伊马替尼治疗达到主要分子学反应(MMR)后)。
- 验证方法:mRNA水平用qRT-PCR(Qiagen引物试剂盒),蛋白水平用Western blot(Abcam抗体),体外结合用EMSA(FITC寡核苷酸),体内结合用ChIP(Qiagen试剂盒)。
- 临床样本验证:5例CML患者的配对样本显示,诊断时(未治疗)c-MYB和ESPL1的mRNA水平显著高于伊马替尼治疗后(MMR状态),且二者变化同步(图2),在体内验证了c-MYB与ESPL1的调控关系。
核心成果提炼
本研究的关键发现是:ESPL1/Separase是c-MYB的直接转录靶基因,c-MYB通过结合ESPL1启动子上调其表达;伊马替尼通过抑制BCR-ABL降低c-MYB水平,进而下调ESPL1/Separase的转录与蛋白表达。这一发现的创新性在于:
1. 首次揭示伊马替尼下调Separase的转录机制——通过c-MYB的中介作用;
2. 建立c-MYB(BCR-ABL下游关键因子)与Separase(基因组稳定性关键酶)的直接调控关系,为CML的基因组不稳定性提供了新的分子通路;
3. 临床意义:c-MYB与ESPL1的同步变化可作为监测伊马替尼治疗效果的潜在Biomarker,其表达水平可能预测克隆演化风险。
统计学结果:伊马替尼处理后CML细胞系中c-MYB和ESPL1的表达下降具有显著性(P<0.05,图1、表1);siRNA沉默后c-MYB和Separase的蛋白水平下降显著(P<0.05,图3);ChIP实验中c-MYB抗体的富集量显著高于对照(P<0.05,图4c)。
关键图片
图1:伊马替尼处理对CML细胞c-MYB和ESPL1表达的影响
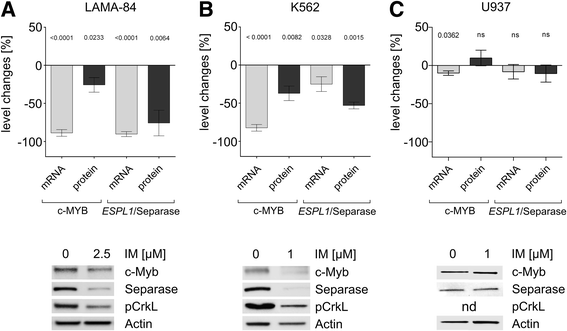
图2:临床样本中c-MYB与ESPL1的表达相关性
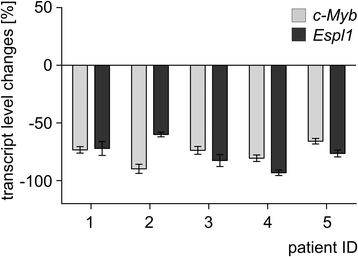
图3:siRNA沉默c-MYB对Separase表达的影响
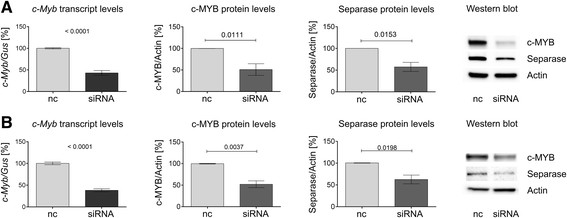
图4:c-MYB与ESPL1启动子的结合验证