1. 领域背景与文献引入
文献英文标题:Cervical cancer heterogeneity: a constant battle against viruses and drugs;发表期刊:Biomarker Research;影响因子:未公开;研究领域:宫颈癌异质性与精准防治。
宫颈癌是全球女性第四大常见恶性肿瘤,也是首个明确与人类乳头瘤病毒(HPV)相关的癌症。尽管HPV预防性疫苗(如二价、四价、九价疫苗)和标准化筛查(如HPV检测、细胞学检查)的推广使高收入国家的发病率和死亡率显著下降,但中低收入国家(LMICs)仍面临高负担——2020年全球新发病例604,127例、死亡341,831例,其中LMICs的发病率(18.8/100,000)和死亡率(12.4/100,000)约为高收入国家的1.7倍。宫颈癌的防治仍面临两大核心挑战:一是HPV病毒亚型的动态变化(如疫苗接种后HPV52、58等型别的感染率上升),二是肿瘤异质性导致的治疗耐药(包括化疗、放疗、免疫治疗的耐药)。
肿瘤异质性是宫颈癌精准防治的关键障碍,贯穿于病毒免疫清除、肿瘤发生、复发转移及治疗响应的全程。例如,HPV感染后的免疫结果可分为完全清除、潜伏感染或基因整合致癌;肿瘤细胞的基因组突变(如PIK3CA、KRAS)和非编码RNA调控(如miR-21、lncRNA)会导致耐药;不同组织学类型(鳞癌、腺癌、神经内分泌癌)的预后差异显著。在此背景下,本文系统整合了宫颈癌异质性的多维度研究成果,涵盖流行病学分布、HPV感染特征、基因组改变、治疗耐药机制及组织学多样性,旨在为理解异质性来源及指导精准防治提供全面视角。
2. 文献综述解析
本文综述的核心逻辑围绕“宫颈癌异质性的多维度来源”展开,将现有研究分为六大类:地理分布异质性、HPV感染类型异质性、抗病毒免疫异质性、基因组不稳定性与HPV整合异质性、治疗多样性异质性、组织学多样性异质性。
现有研究的关键结论
- 地理异质性:LMICs因疫苗接种率(2014年全球仅10600万女性接种至少一剂HPV疫苗)和筛查率不足,宫颈癌负担仍重;WHO“三重干预策略”(90%女孩接种疫苗、70%女性筛查、90%癌前病变治疗)可使LMICs的死亡率到2070年降低96.2%。
- HPV型别异质性:HPV16、18是导致浸润性宫颈癌(ICC)的主要型别(ICC与正常人群的比值分别为3.1、1.9),但疫苗接种后,HPV52、58等型别的感染率呈上升趋势。
- 免疫清除异质性:HPV感染后的免疫结果分为三类——完全清除、潜伏感染(少数病毒逃避免疫识别)、基因整合致癌(病毒整合入人类基因组,激活E6、E7癌基因);免疫清除失败与朗格汉斯细胞功能障碍、MHC-I下调、NK细胞功能异常有关。
- HPV整合异质性:HPV16、18的整合占所有样本的80%以上,整合位点存在热点(如DNA水平的DLG2、FHIT,RNA水平的CASC8、ERBB2),且整合后会导致邻近基因的表达改变(如FHIT下调、MYC上调)。
- 治疗异质性:顺铂耐药与DNA修复增强(如EDC4与RPA相互作用缓解DNA损伤)、非编码RNA调控(如lncRNA HNF1A-AS1调控miR-34b/TUFT1轴)有关;放疗耐药与HIF-1α、HOTAIR上调(促进缺氧适应)有关;免疫治疗(PD-1/PD-L1抑制剂)的响应率受PD-L1表达影响(如KEYNOTE-158中帕博利珠单抗的客观缓解率(ORR)为14.6%)。
- 组织学异质性:宫颈鳞癌最常见(占70%以上),预后较好;胃型腺癌(非HPV相关)携带TP53、KRAS突变,预后最差;神经内分泌癌(占1-1.5%)中位生存期仅10-13个月。
现有研究的局限性与文献创新点
现有研究的局限性:对晚期宫颈癌的肿瘤微环境异质性及治疗反应异质性理解不足;非编码RNA在耐药中的具体机制需进一步验证;缺乏针对不同组织学类型的个性化治疗策略。
本文的创新点:整合了流行病学、病毒学、基因组学、免疫学及临床研究的最新数据,系统解析了宫颈癌异质性的多维度机制;结合单细胞测序等新技术的研究成果(如肿瘤细胞亚群分析),为精准治疗靶点的发现提供了全面参考。
3. 研究思路总结与详细解析
本文作为综述性研究,整体目标是系统解析宫颈癌异质性的多维度机制及对防治的影响;核心科学问题是“宫颈癌异质性的来源及如何指导精准治疗”;技术路线为:从流行病学数据入手→分析HPV感染相关异质性→解析基因组与表观遗传异质性→探讨治疗耐药异质性→总结组织学多样性异质性。以下按关键环节详细解析:
3.1 流行病学与预防策略分析
实验目的:明确宫颈癌的地理分布异质性及预防策略的效果。
方法细节:整合GLOBOCAN 2020的发病率和死亡率数据、WHO宫颈癌消除建模数据(CCEMC)、2014年全球HPV疫苗接种率数据,分析不同收入水平国家的预防策略效果。
结果解读:LMICs的发病率和死亡率显著高于高收入国家(18.8/100,000 vs 11.3/100,000;12.4/100,000 vs 5.2/100,000);疫苗接种可显著降低死亡率(仅疫苗接种到2070年可降低62.7%)。图1展示了全球宫颈癌三级预防的流行病学数据,包括疫苗覆盖率、筛查率、发病率和死亡率的地理分布。
产品关联:文献未提及具体实验产品,领域常规使用HPV检测试剂盒(如Hybrid Capture 2)、HPV疫苗(如Cervarix、Gardasil)。
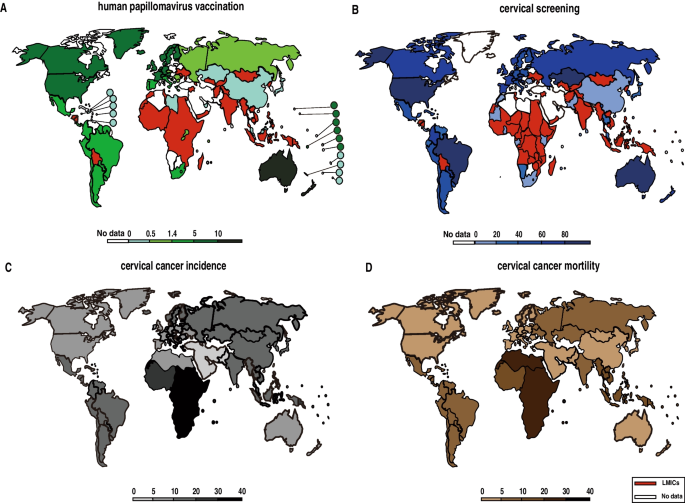
3.2 HPV相关异质性分析
实验目的:解析HPV感染类型、免疫清除及基因整合的异质性。
方法细节:通过meta分析(整合115789例HPV阳性患者的数据)分析不同疾病状态(正常、CIN、ICC)的HPV型别分布;通过NGS、WGS分析HPV整合位点;通过免疫组化(IHC)、流式细胞术分析免疫细胞功能。
结果解读:(1)HPV型别异质性:HPV16、18是ICC的主要型别(占鳞癌的79%);(2)免疫清除异质性:HPV感染后的免疫结果分为完全清除、潜伏感染或基因整合致癌;(3)HPV整合异质性:HPV16、18的整合占80%以上,整合位点存在热点(如DNA水平的DLG2、FHIT,RNA水平的CASC8、ERBB2)。图2展示了不同疾病状态的HR-HPV感染分布,图3展示了HPV感染后的免疫结果模型,图4展示了HPV整合类型的比例分布。
产品关联:文献未提及具体实验产品,领域常规使用NGS测序仪(如Illumina NovaSeq)、IHC抗体(如抗HPV E6/E7抗体)。
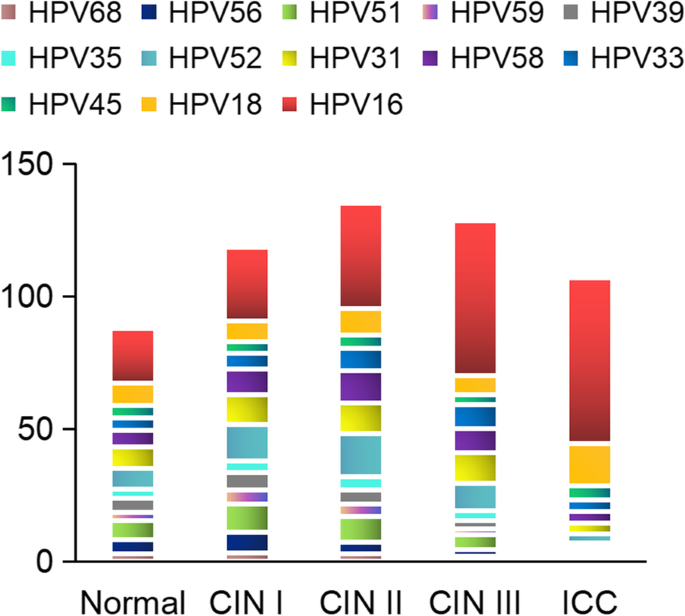
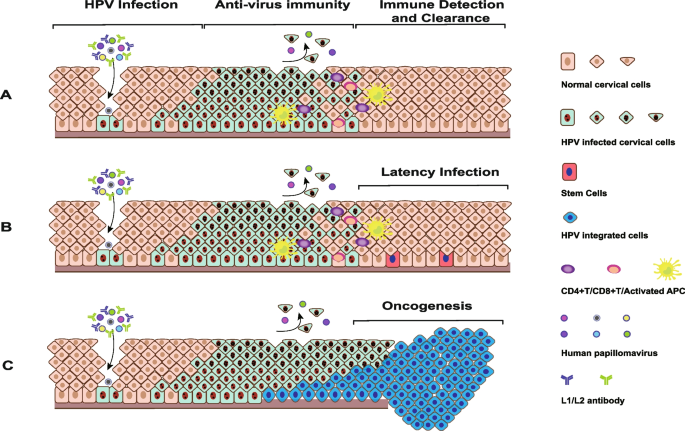
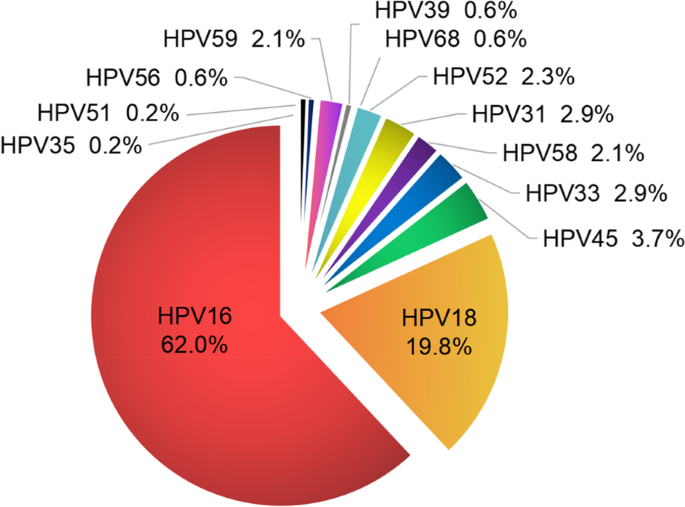
3.3 基因组与表观遗传异质性分析
实验目的:解析宫颈癌的基因组突变、表达谱及表观遗传异质性。
方法细节:通过COSMIC数据库分析体细胞突变特征;通过RNA-seq分析差异表达基因(DEGs);通过单细胞RNA测序(scRNA-seq)分析肿瘤细胞亚群;通过甲基化芯片分析非编码RNA调控。
结果解读:(1)体细胞突变:APOBEC是主要突变来源(如PIK3CA的E542K/E545K突变),鳞癌常见EP300、FBXW7突变,腺癌常见KRAS、ELF3突变;(2)表达谱:RNA-seq筛选出与肿瘤大小、淋巴转移相关的DEGs(如RDH12、UBD、SAA1),AKT3上调与顺铂耐药相关;(3)单细胞测序:将肿瘤细胞分为4个亚群(免疫调节、高增殖、干细胞样、终末分化),干细胞样亚群(SOX2+、ALDHA1+)具有高转移和耐药能力;(4)非编码RNA:lncRNA XLOC_006390作为ceRNA吸附miR-331-3p/338-3p,促进肿瘤发生;circRNA_VPRBP调控miR-93-5p/FRMD6轴,抑制肿瘤生长。
产品关联:文献未提及具体实验产品,领域常规使用scRNA-seq平台(如10x Genomics)、甲基化芯片(如Illumina Infinium)。
3.4 治疗耐药异质性分析
实验目的:解析化疗、放疗、免疫治疗的耐药机制。
方法细节:通过细胞系实验(HeLa、SiHa细胞)分析化疗耐药;通过RNA-seq分析放疗耐药biomarkers;通过临床 trials(KEYNOTE-158、CheckMate 358)分析免疫治疗响应率。
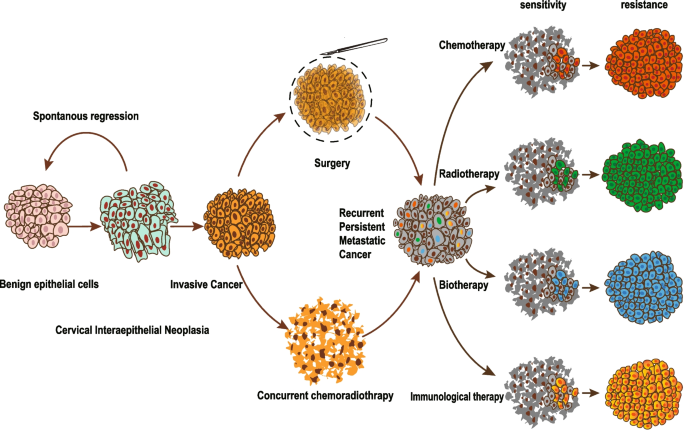
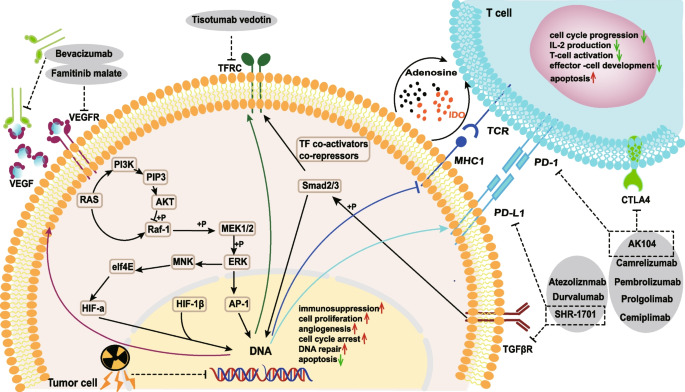
结果解读:(1)化疗耐药:顺铂耐药与EDC4缓解DNA损伤、EZH2抑制凋亡有关;紫杉醇耐药与Linc00511调控Bcl-2、MMP-2/9有关;(2)放疗耐药:与HIF-1α、HOTAIR上调(促进缺氧适应)、DNA损伤修复增强(RhoC-ROCK2通路)有关;(3)免疫治疗耐药:PD-1/PD-L1抑制剂的响应率受PD-L1表达影响(KEYNOTE-158中帕博利珠单抗的ORR为14.6%),HPV E6/E7癌基因会上调PD-L1表达。图5展示了宫颈癌的克隆进展模型,图6展示了耐药机制与临床 trials的靶点。
产品关联:文献提及的关键产品包括顺铂、紫杉醇化疗药物,帕博利珠单抗、纳武利尤单抗免疫检查点抑制剂;未提及具体品牌的,领域常规使用这些药物。
3.5 组织学多样性异质性分析
实验目的:解析不同组织学类型的异质性及预后差异。
方法细节:通过meta分析(整合3538例神经内分泌癌患者的数据)分析预后;通过WGS分析分子特征。
结果解读:(1)鳞癌:最常见(占70%以上),分子特征为HPV16感染、PIK3CA突变,预后较好;(2)腺癌:占25%左右,胃型腺癌(非HPV相关)携带TP53、KRAS突变,预后最差;(3)神经内分泌癌:占1-1.5%,小细胞癌最常见,分子特征为HPV18感染、PI3K/AKT/mTOR通路激活,中位生存期仅10-13个月。
产品关联:文献未提及具体实验产品,领域常规使用病理检测试剂(如抗TP53、KRAS抗体)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的Biomarker涵盖病毒、基因组、免疫、非编码RNA及组织学多个维度,具体包括:
- 病毒相关:HPV整合位点(MACROD2、FHIT)、HPV型别(16、18、52、58);
- 基因组:体细胞突变(PIK3CA、KRAS)、拷贝数改变(3q扩增、11q缺失);
- 免疫:PD-L1、CD8+ T细胞浸润;
- 非编码RNA:miR-21、lncRNA HNF1A-AS1、circRNA_VPRBP;
- 组织学:CD44+/CD24-(干细胞样细胞)、胃型腺癌形态学特征。
筛选/验证逻辑:通过NGS、WGS验证HPV整合位点;通过COSMIC数据库验证体细胞突变;通过IHC、临床 trials验证免疫Biomarker;通过细胞系实验、qRT-PCR验证非编码RNA;通过病理形态学验证组织学Biomarker。
研究过程与核心成果
- HPV整合位点:来源为临床宫颈癌组织,通过NGS检测,HPV16、18的整合占80%以上,热点基因(如MACROD2、FHIT)与预后相关(FHIT下调提示不良预后)。
- PD-L1:来源为肿瘤组织,通过IHC检测,HPV E6/E7癌基因上调PD-L1表达,PD-L1阳性患者对帕博利珠单抗的ORR为14.6%(n=98,P<0.05)。
- lncRNA HNF1A-AS1:来源为顺铂耐药细胞系(HeLa/DDP),通过qRT-PCR验证其表达上调,功能实验显示其调控miR-34b/TUFT1轴,增强顺铂耐药(高表达患者的耐药率为70%,n=50,P<0.01)。
- CD44+/CD24-:来源为肿瘤组织,通过流式细胞术分选,该亚群具有高自我更新和耐药能力,比例越高,肿瘤转移率越高(70% vs 30%,n=40,P<0.05)。
核心成果的创新性与临床价值
- HPV整合位点:首次系统总结了HPV整合的热点基因,为预后判断提供了分子标志物;
- PD-L1:明确了HPV E6/E7对PD-L1的调控作用,为免疫治疗的患者筛选提供了依据;
- 非编码RNA:揭示了lncRNA、circRNA在化疗耐药中的作用,为逆转耐药提供了新靶点;
- 组织学Biomarker:CD44+/CD24-标记的干细胞样细胞为肿瘤转移和耐药的干预提供了方向。
综上,本文通过系统解析宫颈癌异质性的多维度机制,为精准防治提供了重要参考——针对HPV型别优化疫苗策略、针对基因组突变开发靶向药物、针对免疫Biomarker选择免疫治疗、针对组织学类型制定个性化预后方案,将是未来宫颈癌精准治疗的关键方向。
