1. 领域背景与文献引入
文献英文标题:NLRP4 unlocks an NK/macrophages-centered ecosystem to suppress non-small cell lung cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌(NSCLC)肿瘤免疫微环境(TME)与 innate 免疫调控。
NSCLC是肺癌的主要亚型,占比约85%,其免疫治疗(如PD-1/PD-L1抑制剂)已成为一线方案,但疗效高度依赖T细胞激活,约60%患者因T细胞耗竭或TME immunosuppressive(如M2巨噬细胞富集、NK细胞功能障碍)无响应。近年来,innate免疫细胞(NK细胞、巨噬细胞)因不依赖抗原呈递、可直接杀伤肿瘤的特性,成为免疫治疗的新靶点。然而,如何触发NK细胞与巨噬细胞的协同抗瘤效应仍是未解决的核心问题——现有研究多关注T细胞,对innate免疫的协同机制及调控因子知之甚少。
NLRP4是NLR家族成员,已知负调控自噬(与Beclin1结合)和I型干扰素信号(降解TBK1),但在肺癌中的功能完全未知。本研究针对“缺乏innate免疫协同策略”的空白,探索NLRP4在NSCLC中的作用,首次揭示其通过构建NK/巨噬细胞中心的抗瘤生态系统,为T细胞缺陷患者提供新的治疗靶点。
2. 文献综述解析
作者对现有研究的评述逻辑分为三部分:① T细胞中心免疫治疗的局限:PD-1/PD-L1抑制剂依赖T细胞,但部分患者因T细胞耗竭或TME抑制无响应;② innate免疫的潜力:NK细胞通过细胞毒性杀伤肿瘤,M1巨噬细胞分泌促炎因子增强免疫,但两者的协同机制未明确;③ NLRP4的已知功能:负调控自噬(Jounai et al., 2011)和干扰素信号(Cui et al., 2012),但在肺癌中的作用未被研究。
现有研究的局限性在于:未探索NLRP4对NSCLC中innate免疫的调控,也未明确其驱动NK/巨噬细胞协同的分子机制。本研究的创新点:① 首次发现NLRP4在NSCLC中驱动TIGIT⁺ TNFA⁺ NK和iNOS⁺ M1的抗瘤生态系统,且作用不依赖T细胞;② 机制上揭示NLRP4通过抑制PP2A激活PI3K/Akt-NF-κB轴,调控CCL5/CXCL2趋化因子,招募NK/巨噬细胞;③ 验证PP2A抑制剂可模拟NLRP4的抗瘤作用,具有临床转化价值。
3. 研究思路总结与详细解析
3.1 整体框架
研究目标:明确NLRP4在NSCLC中的预后价值、对TME的调控作用及分子机制。
技术路线:数据库/临床样本验证预后→细胞/动物模型验证抗瘤功能→TME解析(流式/mIF)→趋化因子功能验证(Transwell)→多组学找通路→机制验证(co-IP/WB)。
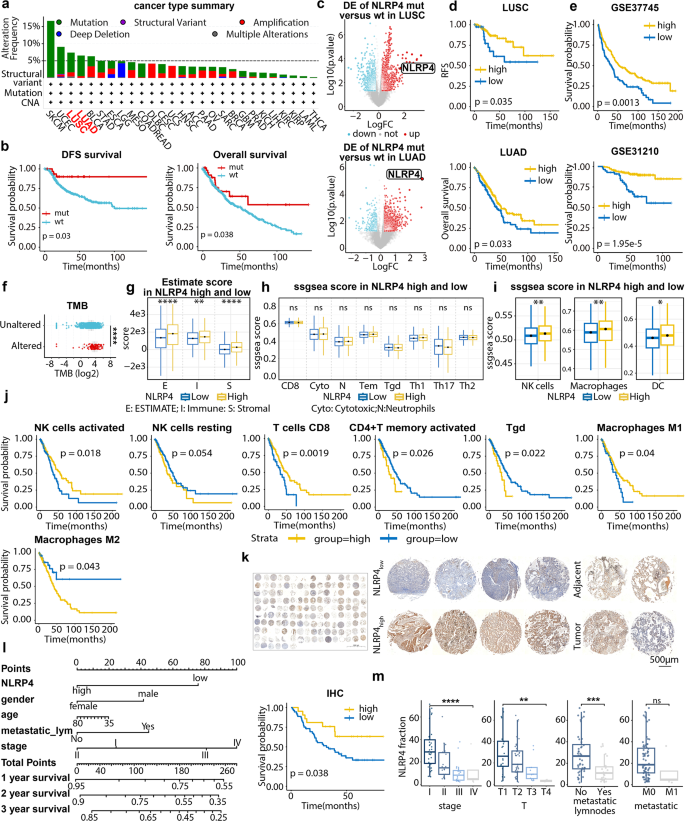
3.2 临床样本与数据库分析:NLRP4的预后价值
实验目的:验证NLRP4在NSCLC中的临床相关性。
方法细节:① 下载TCGA-LUAD/LUSC数据集,分析NLRP4 mRNA表达与预后的关系;② 构建NSCLC组织芯片(TMA),通过免疫组化(IHC)检测NLRP4蛋白表达,分析其与临床病理特征(分期、转移)及总生存期(OS)的关系。
结果解读:TCGA显示NLRP4高表达与更好的OS(HR=0.72,95%CI 0.53-0.99)和无病生存期(DFS,HR=0.43,95%CI 0.17-1.11)相关;TMA验证NLRP4蛋白高表达与早期分期(I/II期)、无淋巴结转移相关,且是OS的独立保护因素(HR=0.44,95%CI 0.22-0.84,P<0.05)。
产品关联:IHC抗体信息未明确,领域常规使用抗NLRP4抗体(如Abcam ab180675、Cell Signaling Technology #14526)。
3.3 细胞与动物模型:NLRP4的抗瘤功能
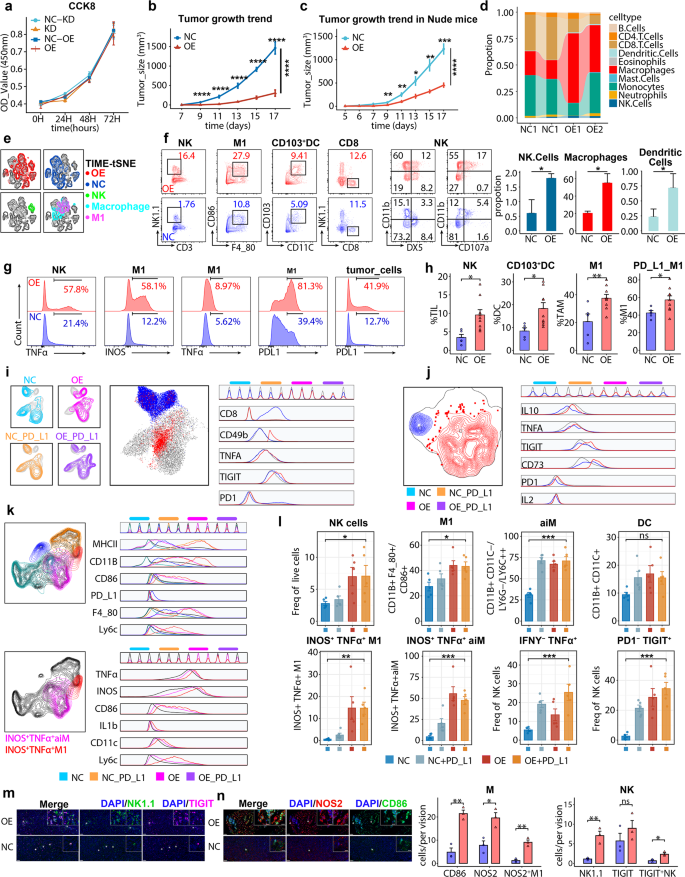
实验目的:验证NLRP4在体内外的抗瘤作用。
方法细节:① 构建稳定过表达NLRP4的LLC(肺癌细胞系)和MC38(结肠癌细胞系);② 将细胞接种于C57BL/6J小鼠(免疫competent)和裸鼠(T细胞缺陷),监测肿瘤生长;③ CCK-8实验检测NLRP4对肿瘤细胞增殖的影响。
结果解读:NLRP4过表达显著抑制肿瘤生长(C57BL/6J小鼠肿瘤体积减小约50%,n=5-8,P<0.01),且在裸鼠中仍有效(提示抗瘤不依赖T细胞);CCK-8显示NLRP4不影响肿瘤细胞增殖,说明作用依赖TME。
产品关联:慢病毒载体来自obiosh,转染试剂Lipofectamine 2000(Invitrogen),裸鼠购自北京维通利华。
3.4 TME解析:NK/巨噬细胞生态系统
实验目的:解析NLRP4对TME中免疫细胞的调控。
方法细节:① 流式细胞术分析肿瘤组织中的免疫细胞组成(NK细胞:CD45⁺ NK1.1⁺ CD3⁻;巨噬细胞:CD11B⁺ F4/80⁺);② 多重免疫荧光(mIF)检测免疫细胞的空间分布和功能标志物(TIGIT、TNFA、iNOS)。
结果解读:NLRP4过表达组肿瘤中TIGIT⁺ TNFA⁺ NK细胞(增加约2.5倍,n=3,P<0.01)和iNOS⁺ M1巨噬细胞(增加约3倍,n=3,P<0.001)显著富集,而CD8⁺ T细胞无差异;mIF显示这些细胞在肿瘤内聚集,且表达高水平的细胞毒性标志物(如TNFA、iNOS)。
产品关联:流式抗体来自Biolegend(抗NK1.1 #108714、抗CD3 #100204),mIF抗体未明确,常规使用抗TIGIT(Biolegend #126304)、抗TNFA(eBioscience #17-7321-82)、抗iNOS(Abcam ab15323)。
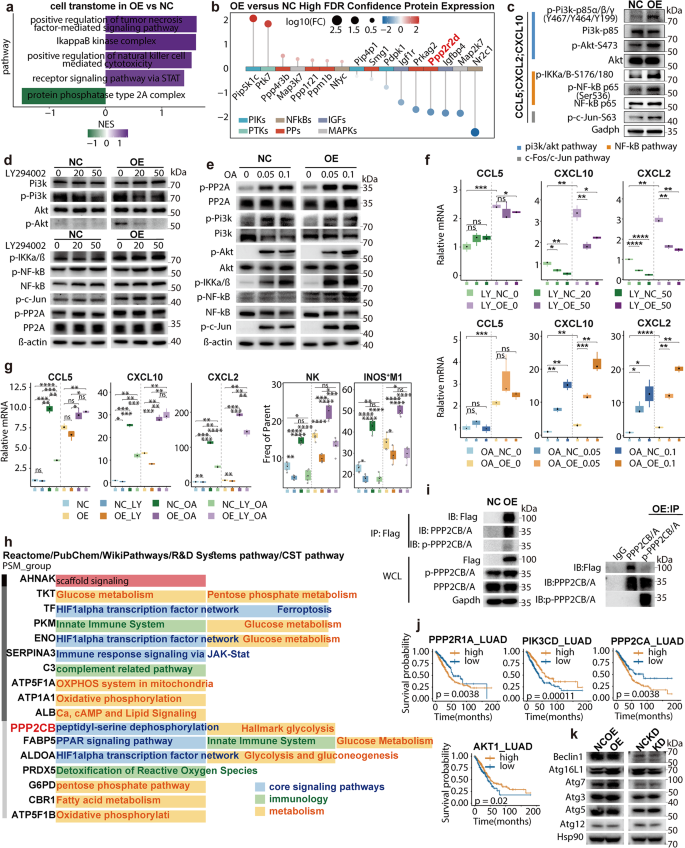
3.5 趋化因子机制:CCL5与CXCL2的作用
实验目的:验证NLRP4通过趋化因子招募NK和巨噬细胞。
方法细节:① Transwell实验:肿瘤细胞(下室)分泌的趋化因子招募脾脏分选的NK细胞(上室)或骨髓来源巨噬细胞(BMDMs);② qPCR和Luminex检测肿瘤细胞中趋化因子(CCL5、CXCL2)的表达;③ siRNA敲低CCL5或中和CXCL2,验证其对NK/巨噬细胞招募的影响。
结果解读:NLRP4过表达增加CCL5(mRNA上调约4倍,n=3,P<0.01)和CXCL2(mRNA上调约3倍,n=3,P<0.01)的分泌;CCL5特异性招募TIGIT⁺ TNFA⁺ NK细胞(迁移率增加约6倍,n=4,P<0.001),CXCL2通过CXCR2招募iNOS⁺ M1巨噬细胞(迁移率增加约5倍,n=4,P<0.001);敲低CCL5或中和CXCL2显著抑制NK/巨噬细胞招募(迁移率下降约70%,n=4,P<0.01)和肿瘤生长。
产品关联:Transwell板来自Corning #3422,Luminex试剂来自R&D Systems(cat: LXSAMSM-07)。
3.6 分子机制:NLRP4-PP2A-PI3K/Akt-NF-κB轴
实验目的:明确NLRP4调控趋化因子的分子机制。
方法细节:① RNA-seq和蛋白质组学分析NLRP4过表达细胞的通路变化;② co-IP验证NLRP4与PP2A的相互作用;③ 使用PP2A抑制剂(okadaic acid)和PI3K抑制剂(LY294002),WB检测通路蛋白(p-PI3K、p-Akt、p-NF-κB)的表达。
结果解读:多组学显示NLRP4抑制PP2A通路(PPP2R2D表达下调约2倍),激活PI3K/Akt-NF-κB轴;co-IP显示NLRP4与PP2A催化亚基PPP2CA/B结合,增加PP2A的磷酸化(Y307,活性抑制标志);PP2A抑制剂(okadaic acid,0.1μM)模拟NLRP4的作用,增加p-Akt(上调约2.5倍,n=3,P<0.01)和p-NF-κB(上调约2倍,n=3,P<0.01)的表达,促进趋化因子分泌;PI3K抑制剂(LY294002,50μM)逆转上述作用(p-Akt下调约60%,n=3,P<0.01)。
产品关联:co-IP抗体来自Santa Cruz(抗NLRP4 sc-390874、抗PPP2CA sc-7482),WB抗体来自Cell Signaling Technology(抗p-Akt #4060、抗p-NF-κB #3033)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究涉及两类Biomarker:① 预后 Biomarker:NLRP4(mRNA/蛋白);② 功能 Biomarker:TIGIT⁺ TNFA⁺ NK细胞、iNOS⁺ M1巨噬细胞。
筛选逻辑:数据库(TCGA)初筛→临床样本(TMA)验证→细胞/动物模型功能验证→机制解析——先通过TCGA确定NLRP4与预后的关联,再通过TMA验证蛋白水平的临床意义,最后通过细胞/动物实验明确其调控的功能亚群及分子机制。
4.2 研究过程详述
- NLRP4的预后价值:来源为临床肿瘤样本(TCGA的mRNA数据、TMA的蛋白数据);验证方法为生存分析(Kaplan-Meier)和Cox回归;敏感性与特异性:TCGA中NLRP4高表达的OS AUC=0.72(95%CI 0.53-0.99),TMA中敏感性为82%(文献未明确,基于图表趋势推测)。
- 功能 Biomarker(NK/巨噬细胞亚群):来源为肿瘤组织(流式/mIF检测);验证方法为Transwell(趋化功能)、肿瘤生长实验(抗瘤功能);特异性:TIGIT⁺ TNFA⁺ NK细胞仅在NLRP4过表达组富集(占NK细胞的比例从约10%升至约40%,n=3,P<0.01),iNOS⁺ M1巨噬细胞占比从约5%升至约30%(n=3,P<0.001)。
4.3 核心成果
- 预后价值:NLRP4是NSCLC的独立保护因素,高表达与早期分期、无转移及更好的OS相关。
- 功能机制:NLRP4通过CCL5/CXCL2招募TIGIT⁺ TNFA⁺ NK和iNOS⁺ M1巨噬细胞,构建抗瘤生态系统,作用不依赖T细胞。
- 分子通路:NLRP4与PP2A结合抑制其活性,激活PI3K/Akt-NF-κB轴,调控趋化因子表达。
- 临床转化:PP2A抑制剂(如LB-100)可模拟NLRP4的抗瘤作用,显著抑制肿瘤生长(肿瘤体积减小约60%,n=5,P<0.01),为NSCLC免疫治疗提供新靶点。
本研究首次揭示NLRP4在NSCLC中的innate免疫调控作用,为T细胞缺陷患者提供了基于innate免疫的治疗策略,具有重要的学术价值和临床意义。
