1. 领域背景与文献引入
文献英文标题:Development and validation of predictive models combining cell-Free DNA motifs and protein biomarkers for early detection of esophageal squamous cell carcinoma and precancerous lesion;发表期刊:Biomarker Research;影响因子:未公开;研究领域:食管鳞状细胞癌(ESCC)及癌前病变早期检测。
食管癌是中国第六大常见恶性肿瘤、第五大癌症死亡原因,早期无症状的特点导致约70%患者确诊时已达晚期,5年生存率不足20%。内镜筛查是ESCC早期检测的金标准,可降低34%死亡率和30%发病率,但存在有创性、患者依从性低、基层医疗资源不足等局限。液体活检作为非侵入性替代方法,逐渐成为研究热点:临床常用的肿瘤相关蛋白生物标志物(如细胞角蛋白19片段Cyfra21-1、癌胚抗原CEA)特异性较高(约90%),但早期ESCC敏感性不足(<50%);游离DNA(cfDNA)检测(如甲基化、突变)在肝癌、肺癌中显示出早期检测潜力,但ESCC领域的研究多聚焦晚期病例,鲜少纳入癌前病变(食管鳞状上皮内瘤变ESPL,包括低级别LGIN、高级别HGIN),且单一组学模型难以兼顾敏感性与特异性。
当前研究空白在于:缺乏纳入大量癌前病变和早期ESCC的多组学预测模型,未充分结合cfDNA末端motif(反映核酸酶活性和组织来源的新型标志物)与临床常用蛋白生物标志物的协同作用。本研究旨在开发cfDNA motif模型、蛋白模型及联合模型,验证其对ESCC及癌前病变的早期检测性能,为非侵入性筛查提供新工具。
2. 文献综述解析
作者对现有ESCC早期检测研究按技术类型分为四类:内镜筛查、蛋白生物标志物检测、cfDNA单组学检测、多组学模型。
现有研究的关键结论与局限性:①内镜筛查是金标准,可显著降低死亡率,但有创性限制了普及;②蛋白生物标志物(如Cyfra21-1)操作简便、特异性高,但早期ESCC敏感性不足(<50%);③cfDNA甲基化/突变模型对早期ESCC敏感性低(如stage 0 ESCC敏感性仅50%),且多未纳入癌前病变;④多组学模型(如cfDNA+蛋白)在胰腺癌、肝癌中提高了早期检测准确性,但ESCC领域相关研究极少,未充分验证协同效应。
本研究的创新点:①队列代表性:纳入46例LGIN、45例HGIN、100例T1aN0 ESCC及24例T1bN0 ESCC,占总样本43.8%,是少数系统纳入癌前病变与早期ESCC的研究;②标志物创新:首次将cfDNA末端motif(反映片段化特征的新型标志物)与临床常用蛋白生物标志物结合,开发多组学模型;③临床相关性:重点验证模型对可内镜治疗的HGIN+T1aN0 ESCC的敏感性,贴合“早诊早治”的临床需求。
3. 研究思路总结与详细解析
整体框架
研究目标:开发联合cfDNA motif与蛋白生物标志物的预测模型,提高ESCC及癌前病变早期检测准确性;核心科学问题:多组学标志物能否协同提升早期病变的敏感性与特异性;技术路线:样本收集→cfDNA测序+蛋白检测→差异特征筛选→模型构建(随机森林)→多数据集验证(训练、验证、测试集)。
3.1 研究队列建立与样本收集
实验目的:建立包含ESCC、癌前病变及健康对照的均衡队列,确保模型验证可靠性。
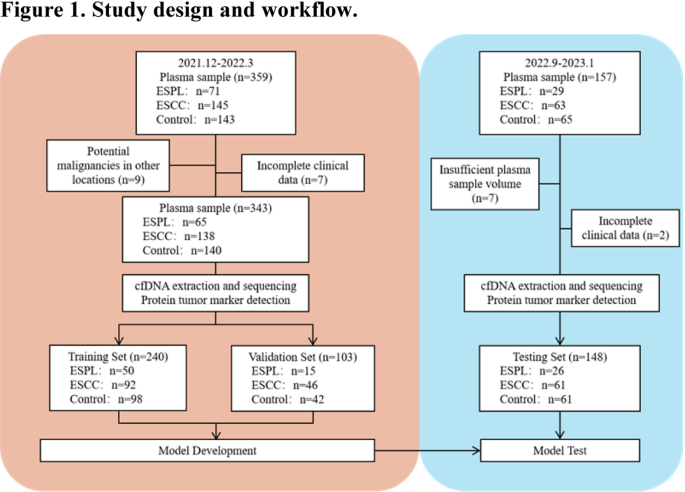
方法细节:2021年12月至2022年3月收集中国医学科学院肿瘤医院内镜科患者血浆样本,纳入199例ESCC、91例ESPL(46 LGIN、45 HGIN)、201例对照(良性食管疾病或健康人);2022年9月至2023年1月前瞻性收集验证样本,最终491例样本随机分为训练集(n=240)、验证集(n=103)、测试集(n=148)。
结果解读:三组数据集在年龄(p=0.576)、性别(χ²=0.93,p=0.628)、吸烟史(χ²=4.50,p=0.343)、饮酒史(χ²=2.13,p=0.711)、组分布(χ²=7.26,p=0.509)上无显著差异,确保了模型验证的客观性。
产品关联:文献未提及具体样本收集产品,领域常规使用cfDNA保存管(如Streck管)、EDTA抗凝管。
3.2 cfDNA测序与motif特征提取
实验目的:获取cfDNA末端motif特征,筛选差异序列。
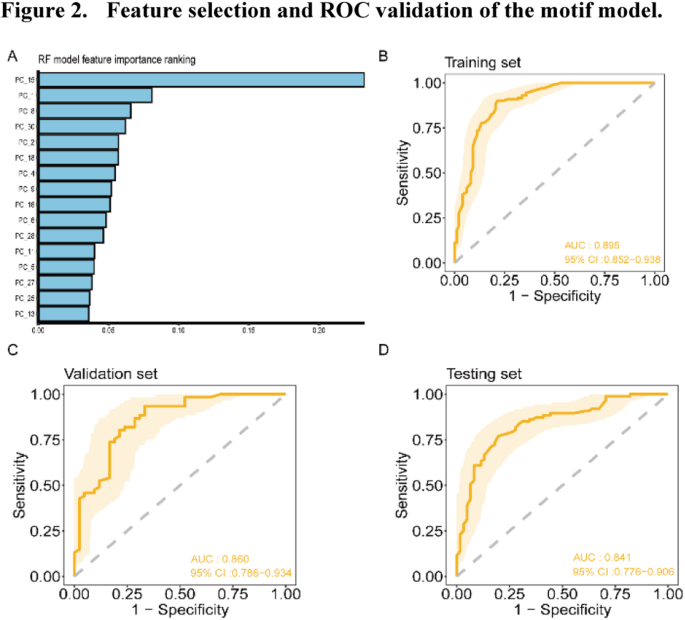
方法细节:血浆cfDNA提取后,用Qiagen QIAseq cfDNA All-in-One Kit构建文库,MGI 2000/T7平台进行PE100测序(深度10G);过滤低质量reads后比对至hg19基因组,提取cfDNA片段末端4碱基序列,计算每种序列占比并Z-score标准化;训练集通过t检验(p<0.05)筛选差异motif,PCA降维至30维,再用随机森林递归特征消除(RF-RFE)选16维最优特征。
结果解读:训练集筛选到203个差异motif(128个下调、75个上调),hierarchical clustering显示这些motif可有效区分病例与对照;PCA降维后保留了90%以上的原始信息,减少了特征冗余。
产品关联:实验所用关键产品:Qiagen QIAseq cfDNA All-in-One Kit(文库构建)、Thermo Fisher Scientific Qubit 1×dsDNA assay kit(文库定量)、BiOptic Qsep-400毛细管电泳系统(文库质量控制)、BGI MGI 2000/T7测序平台(测序)。
3.3 蛋白生物标志物检测与特征筛选
实验目的:检测临床常用消化系蛋白生物标志物,筛选差异特征。
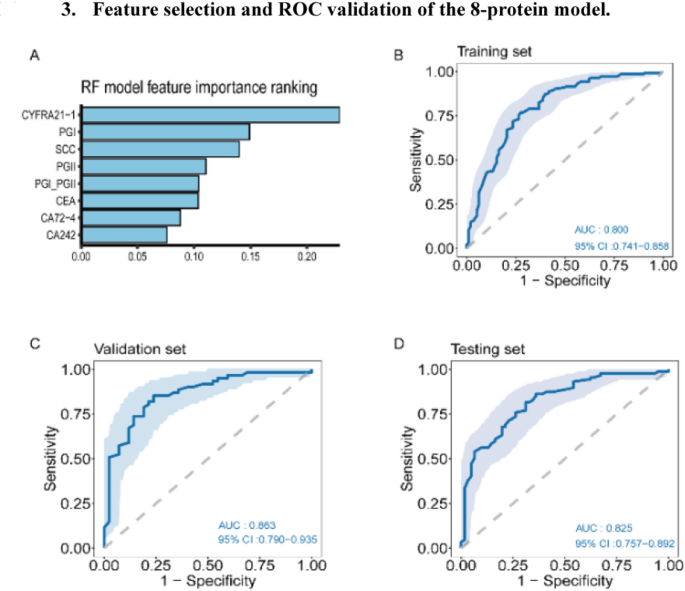
方法细节:用DIRUI CM-180全自动化学发光免疫分析系统及配套试剂,检测9种蛋白:甲胎蛋白(AFP)、糖类抗原19-9(CA19-9)、糖类抗原24-2(CA24-2)、糖类抗原72-4(CA72-4)、癌胚抗原(CEA)、细胞角蛋白19片段(Cyfra21-1)、鳞状细胞癌抗原(SCC)、胃蛋白酶原I(PG I)、胃蛋白酶原II(PG II),并计算PG I/PG II比值(PGR);训练集通过t检验筛选差异蛋白,RF-RFE选8种最优特征。
结果解读:训练集筛选到5种差异蛋白(CEA、Cyfra21-1、PG I、PG II、PGR),其中Cyfra21-1在ESCC组水平显著高于对照(p<0.05),但测试集敏感性仅62.1%,单独使用价值有限。
产品关联:实验所用关键产品:DIRUI化学发光免疫分析试剂 kit(生物标志物检测)、DIRUI CM-180全自动化学发光免疫分析系统(检测平台)。
3.4 预测模型构建与验证
实验目的:分别构建cfDNA motif模型、蛋白模型及联合模型,验证其检测性能。
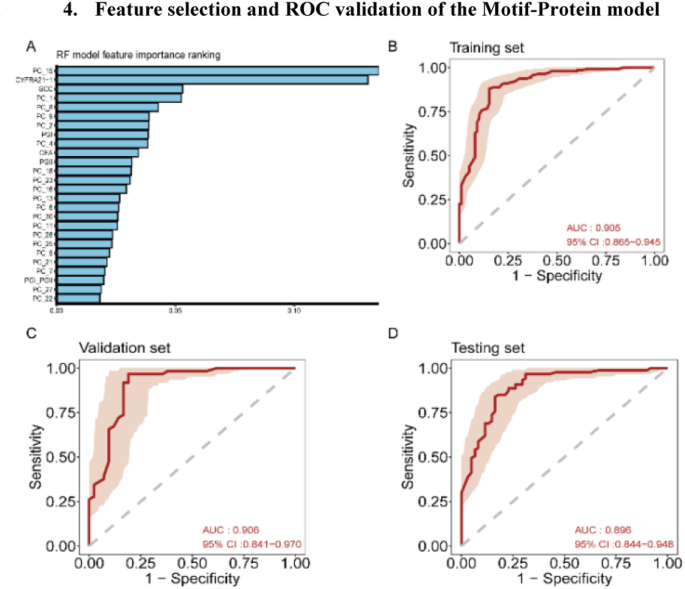
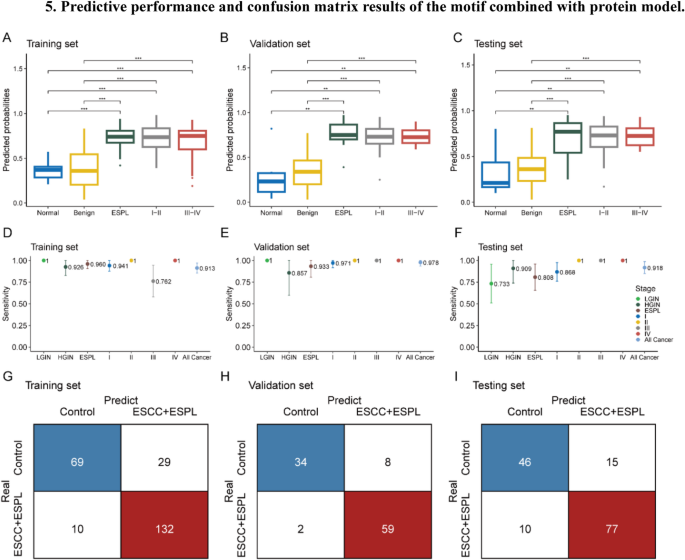
方法细节:①motif模型:用16维cfDNA motif特征,随机森林算法10折交叉验证构建模型,验证集基于Youden指数确定最优阈值(0.39);②蛋白模型:用8种蛋白特征(CA24-2、CA72-4、CEA、Cyfra21-1、SCC、PG I、PG II、PGR),同样用随机森林10折交叉验证,最优阈值0.55;③联合模型:整合20维cfDNA motif特征(RF-RFE筛选)与6种蛋白特征(RF-RFE筛选),随机森林10折交叉验证,最优阈值基于Youden指数。
结果解读:①motif模型:训练集AUC0.89、验证集0.86、测试集0.84,测试集HGIN敏感性100%(n=10)、LGIN敏感性93.3%(n=15,95%CI80.7%-100%),HGIN+T1aN0 ESCC敏感性90.2%(n=51,95%CI81.2%-99.3%),对癌前病变的敏感性优势显著;②蛋白模型:训练集AUC0.80、验证集0.86、测试集0.82,测试集ESCC敏感性88.5%(n=199),HGIN+T1aN0敏感性80.5%(n=41,95%CI68.4%-92.6%),优于单个蛋白(如Cyfra21-1测试集敏感性62.1%);③联合模型:训练集AUC0.90、验证集0.91、测试集0.90,测试集整体敏感性88.5%、特异性75.4%,HGIN敏感性90.9%(n=11,95%CI73.9%-100%),Stage I ESCC敏感性86.8%(n=38,95%CI76.1%-97.6%),HGIN+T1aN0敏感性87.8%(n=41,95%CI77.8%-97.8%),性能显著优于单一组学模型。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及两类生物标志物:①cfDNA末端motif:通过测序提取的4碱基末端序列,经“训练集t检验→PCA降维→RF-RFE”筛选得到20维核心特征,反映cfDNA的片段化模式;②蛋白生物标志物:临床常用消化系蛋白,经“训练集t检验→RF-RFE”筛选得到6种核心特征(CA24-2、CA72-4、CEA、Cyfra21-1、SCC、PGR),覆盖肿瘤增殖、分化及胃黏膜功能。
研究过程详述
Biomarker来源:所有标志物均来自血浆样本,符合液体活检的非侵入性要求;验证方法:cfDNA motif通过测序及生物信息学分析验证,蛋白通过化学发光免疫分析验证;特异性与敏感性:联合模型测试集AUC=0.90,敏感性88.5%,特异性75.4%,均优于单一组学模型(motif模型测试集AUC0.84、蛋白模型0.82);cfDNA motif模型对HGIN的敏感性达100%(测试集),蛋白模型对ESCC的敏感性达88.5%(测试集),协同效应显著。
核心成果
- cfDNA motif是癌前病变的高敏感性标志物:尤其对HGIN(测试集敏感性100%),填补了现有模型对癌前病变检测的空白;
- 联合模型协同提升早期检测性能:对可内镜治疗的HGIN+T1aN0 ESCC敏感性达87.8%,显著高于motif模型的90.2%(无统计学差异,但特异性从55.7%提升至75.4%)和蛋白模型的80.5%;
- 蛋白模型优于单个蛋白:8种蛋白模型测试集敏感性81.6%,高于Cyfra21-1的62.1%,证明多蛋白组合可提升早期检测的敏感性。
创新性在于首次将cfDNA motif与临床蛋白结合,建立了纳入大量癌前病变的多组学模型,为ESCC早期筛查提供了非侵入性、高敏感性的工具,解决了现有模型“重晚期、轻早期”“重单组学、轻协同”的问题。
本研究通过多组学整合与大样本验证,为ESCC及癌前病变的早期检测提供了新的非侵入性方案,有望提高筛查依从性和早期诊断率,最终降低ESCC死亡率。
