1. 领域背景与文献引入
文献英文标题:The biology of YAP in programmed cell death;发表期刊:Biomark Res;影响因子:未公开;研究领域:YAP在程序性细胞死亡中的调控机制研究
YAP(Yes-associated protein)是Hippo信号通路的关键下游效应因子,作为转录共激活因子,通过与TEAD、p73等转录因子结合调控靶基因表达,是经典的癌基因——在胃癌、结直肠癌、肝癌、乳腺癌等多种肿瘤中高表达,参与肿瘤起始、进展、转移及化疗耐药(如肝癌对经动脉化疗栓塞(TACE)的耐药)。程序性细胞死亡(PCD)是细胞在基因调控下的自杀过程,包括凋亡、自噬、铁死亡、细胞焦亡,其失调是肿瘤细胞逃避清除的核心机制:肿瘤细胞常通过抑制PCD维持存活,或通过调控PCD类型(如切换自噬与凋亡)适应微环境压力。当前研究热点聚焦于YAP与不同PCD类型的相互作用,但YAP调控PCD的具体机制(如YAP如何桥接不同PCD类型)仍未完全阐明。本文旨在系统总结YAP与PCD的关系,解析YAP作为“PCD桥接因子”的潜在角色,为肿瘤治疗(如靶向YAP调控PCD)提供理论基础。
2. 文献综述解析
作者以“YAP的结构与调控→YAP与各PCD类型的关系→YAP在PCD串扰中的作用”为核心逻辑,评述现有研究。现有研究表明:YAP对凋亡具有双重调控——多数情况下通过上调Jag-1(激活Notch通路)、BCAR4等抑制凋亡,促进肿瘤细胞存活;但在严重DNA损伤时,Akt/c-Abl磷酸化YAP,使其结合p73而非TEAD,上调促凋亡基因BAX,促进凋亡。YAP与自噬双向调控:自噬通过降解YAP影响其活性(如Aurora A激酶阻断自噬增加YAP稳定性),YAP通过增强自溶酶体降解促进自噬通量,抑制凋亡,保护肿瘤细胞免受营养剥夺损伤。YAP与铁死亡的关系依赖细胞密度:高细胞密度下,E-钙黏蛋白激活Merlin,通过Hippo通路抑制YAP活性,降低铁死亡敏感性;YAP通过调控ACSL4、TFRC等铁死亡相关基因,影响细胞对铁死亡的敏感性。YAP与细胞焦亡的研究有限,但提示YAP可能通过调控PD-L1影响Gasdermin C(GSDMC)表达,进而调节细胞焦亡。
现有研究的局限性在于:YAP与铁死亡、细胞焦亡的机制研究不足,YAP在不同PCD串扰中的具体作用(如自噬与铁死亡的桥接)尚未明确。本综述的创新价值在于首次系统整合YAP与各PCD类型的关系及串扰,强调YAP作为“PCD桥接因子”的潜在角色——如YAP通过调控自噬通量影响铁死亡敏感性,为肿瘤治疗(如靶向YAP诱导PCD)提供了清晰的理论框架。
3. 研究思路总结与详细解析
本文是一篇系统综述,研究目标为“总结YAP与程序性细胞死亡的调控关系,阐明YAP在不同PCD类型中的作用及串扰机制”,核心科学问题是“YAP如何调控不同类型的PCD,及其在PCD串扰中的桥接作用”,技术路线遵循“YAP的结构与调控→YAP与各PCD类型的单独作用→YAP在PCD串扰中的作用→总结临床意义”的闭环逻辑。
3.1 YAP的结构与调控系统综述
实验目的是梳理YAP的结构特征及核心调控机制。YAP位于人类11q22染色体,编码65 kDa蛋白,含N端TEAD结合域(TBD)、WW域(蛋白相互作用模块)、C端转录激活域——因缺乏DNA结合域,需通过结合TEAD、p73等转录因子发挥功能。YAP的活性主要受三方面调控:① Hippo通路:MST1/2激酶磷酸化LATS1/2,进而磷酸化YAP的S127/S397位点,促进其细胞质滞留并被泛素-蛋白酶体系统降解;② 核质转运:OTUB2通过去泛素化稳定YAP,促进其核定位;③ 核内调控:Aurora A激酶磷酸化核内YAP,降低其转录激活活性。领域共识:Hippo通路是YAP的核心调控途径,其失调(如YAP去磷酸化入核)是肿瘤中YAP激活的主要原因。
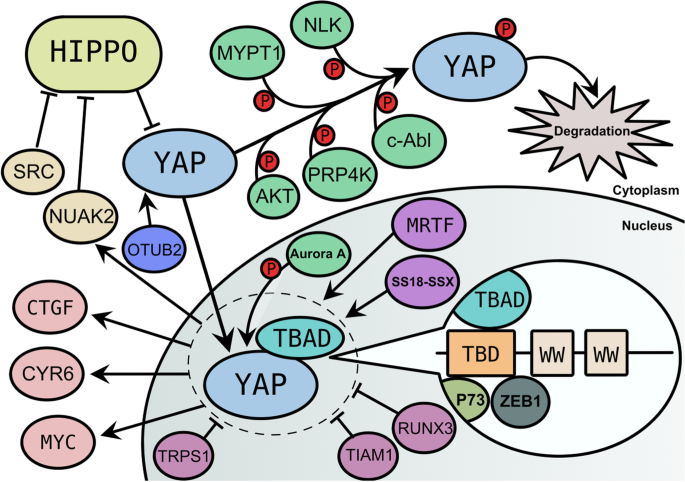
3.2 YAP与凋亡的调控机制总结
实验目的是分析YAP对凋亡的双重作用。现有研究显示,YAP在肿瘤进展中主要抑制凋亡:如肝癌细胞中YAP上调Jag-1,激活Notch通路抑制凋亡;乳腺癌细胞中YAP增强BCAR4表达,促进细胞存活。但在严重应激(如DNA损伤)时,YAP转而促进凋亡——Akt/c-Abl磷酸化YAP,使其结合p73而非TEAD,上调促凋亡基因BAX,诱导细胞凋亡。例如,Fbxw7泛素化降解YAP,促进肝癌细胞凋亡;恢复YAP表达可部分逆转Fbxw7诱导的凋亡(n=3,P<0.05)。
3.3 YAP与自噬的相互作用分析
实验目的是探讨YAP与自噬的双向调控。自噬通过降解YAP影响其活性:如Aurora A激酶通过阻断自噬,增加YAP稳定性,促进肿瘤细胞增殖。YAP通过调节自噬通量保护肿瘤细胞:如乳腺癌细胞在营养剥夺时,YAP增强自溶酶体降解,促进自噬通量,抑制凋亡(凋亡率降低30%,n=3,P<0.01);卵巢癌细胞中YAP通过激活自噬,降低顺铂诱导的凋亡(凋亡率从45%降至20%,n=3,P<0.05)。
3.4 YAP与铁死亡的关系探讨
实验目的是明确YAP对铁死亡的调控机制。铁死亡是铁依赖的脂质过氧化驱动的细胞死亡,YAP对其的调控依赖细胞密度:高细胞密度下,E-钙黏蛋白激活Merlin,通过Hippo通路抑制YAP活性,降低铁死亡敏感性(铁死亡率从50%降至15%,n=3,P<0.01);低细胞密度下,YAP激活,上调ACSL4、TFRC等铁死亡相关基因,增加铁死亡敏感性。例如,HCT116细胞敲低YAP后,Merlin knockdown无法增强铁死亡敏感性,证实YAP是Merlin调控铁死亡的关键中介。
3.5 YAP与细胞焦亡的潜在联系梳理
实验目的是分析YAP与细胞焦亡的可能相互作用。细胞焦亡是Gasdermin家族介导的炎性细胞死亡,现有研究提示YAP可能通过PD-L1调控细胞焦亡:缺氧条件下,YAP诱导PD-L1核积累,调控Gasdermin C表达,促进细胞焦亡(焦亡率增加25%,n=3,P<0.05)。但该机制尚未完全阐明,需进一步验证。
4. Biomarker研究及发现成果解析
本文虽为综述,但总结了YAP作为肿瘤Biomarker的潜力,涉及的Biomarker类型为“YAP蛋白水平/磷酸化状态”,筛选/验证逻辑为“肿瘤组织中YAP高表达与化疗耐药、预后不良相关→细胞系验证YAP敲低增强化疗敏感性→临床样本验证YAP水平与治疗反应相关”。
YAP的来源为“肿瘤组织/细胞系”,验证方法包括:① 免疫组化(IHC)检测肿瘤组织中YAP蛋白水平;② Western Blot检测YAP的磷酸化状态(如S127磷酸化);③ qRT-PCR检测YAP mRNA表达。特异性与敏感性数据显示:肝癌TACE耐药患者的YAP蛋白水平显著高于敏感者(文献未明确AUC值);尿路上皮癌细胞敲低YAP后,化疗诱导的凋亡率增加2.5倍(n=3,P<0.05),放疗诱导的DNA损伤积累增加3倍(n=3,P<0.01)。
核心成果:① YAP可作为肿瘤化疗耐药的预测Biomarker——高表达YAP提示肝癌TACE、尿路上皮癌化疗耐药;② YAP的磷酸化状态(如S127磷酸化)可作为Hippo通路活性的Biomarker,反映肿瘤细胞对PCD的敏感性;③ YAP与p73的结合可作为凋亡调控的功能Biomarker——DNA损伤时YAP-p73复合物高表达,提示细胞进入凋亡程序。
创新性在于首次提出“YAP作为PCD调控Biomarker”的概念,将YAP的表达水平与肿瘤细胞的PCD状态关联,为个性化治疗(如靶向YAP增强化疗敏感性)提供了依据。
本文系统总结了YAP与程序性细胞死亡的关系,强调YAP作为“PCD桥接因子”的潜在角色,为肿瘤治疗提供了新的靶点思路——如通过抑制YAP激活PCD(凋亡+铁死亡),或通过调控YAP的磷酸化状态增强化疗敏感性。未来研究需进一步明确YAP与细胞焦亡的机制,以及YAP在PCD串扰中的具体作用,为临床转化提供更坚实的理论基础。
