1. 领域背景与文献引入
文献英文标题:Insights into genetic aberrations and signalling pathway interactions in chronic lymphocytic leukemia: from pathogenesis to treatment strategies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:慢性淋巴细胞白血病(CLL)的遗传与信号通路机制。
慢性淋巴细胞白血病(CLL)是西方成人最常见的白血病,约占白血病病例的25-30%,其特征是成熟B淋巴细胞的克隆性积累。过去几十年,CLL的治疗经历了从传统化疗免疫治疗(如FCR方案:氟达拉滨+环磷酰胺+利妥昔单抗)到靶向治疗(如BTK抑制剂ibrutinib、BCL2抑制剂venetoclax)的范式转移,显著改善了患者预后,但耐药问题(如BTK C481S突变、BCL2 G101V突变)和遗传异质性仍是临床挑战。当前研究热点包括:CLL的遗传异常谱、信号通路相互作用、靶向治疗的耐药机制、个性化治疗策略;未解决的核心问题有:遗传异常如何通过通路相互作用驱动发病?靶向治疗后的耐药机制如何动态演化?通路间的交叉对话如何影响治疗效果?本研究针对这些问题,系统解析CLL的遗传异常与信号通路相互作用,为发病机制和治疗策略提供新洞察。
2. 文献综述解析
文献综述的核心评述逻辑按“信号通路分类→异常机制→治疗策略→耐药机制”维度组织,涵盖BCR通路、NF-κB通路、PI3K/AKT通路、ROR1通路、凋亡通路(BCL2家族)、DNA损伤修复通路(TP53、ATM)、RNA剪接通路(SF3B1)、炎症通路(MYD88)、NOTCH1通路等9类关键通路。
现有研究的关键结论:①CLL的发病是多基因、多通路异常的结果,如BCR通路的持续激活驱动细胞增殖,BCL2家族的失衡抑制凋亡;②靶向治疗(如BTK抑制剂)可有效抑制肿瘤细胞,但易通过靶基因突变(如BTK C481S)或通路代偿激活(如ROR1通路替代BCR通路)产生耐药;③通路间的交叉对话(如BCR与ROR1通路的相互作用)是耐药的重要机制。
现有研究的局限性:①对通路间的复杂相互作用解析不足,如RNA剪接通路(SF3B1突变)与DNA损伤修复通路的关联未完全阐明;②缺乏对罕见遗传异常(如MYD88 L265P突变)的大规模临床研究;③耐药机制的动态演化(如治疗过程中耐药克隆的扩张)未完全阐明。
本研究的创新价值:首次系统关联CLL的遗传异常与信号通路相互作用,强调通路交叉对话对发病和耐药的影响,为个性化治疗提供理论基础——例如,针对BCR通路耐药的患者,可联合抑制ROR1通路以阻断代偿机制。
3. 研究思路总结与详细解析
整体框架
研究目标:解析CLL的遗传异常与信号通路相互作用,明确发病机制与治疗策略;
核心科学问题:遗传异常如何通过信号通路相互作用导致CLL发病及耐药?;
技术路线:通路解析(基因组学+转录组学)→机制验证(细胞/动物模型)→治疗策略探讨(靶向药物+联合方案)。
3.1 关键信号通路解析
实验目的:鉴定CLL中异常激活的关键信号通路。
方法细节:综合利用全基因组测序(WGS)、全外显子测序(WES)、RNA-seq分析CLL患者的遗传异常;通过CLL细胞系(如MEC-1)和异种移植小鼠模型验证通路异常的功能。
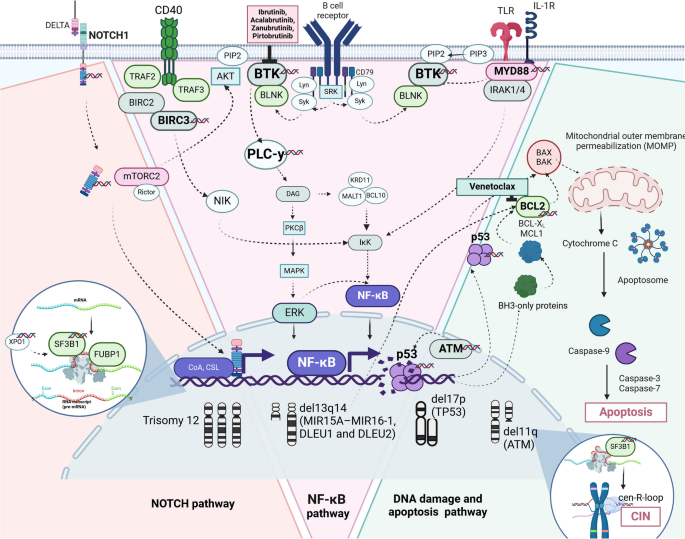
结果解读:发现BCR通路(BTK、PLCγ2突变)、NF-κB通路(BIRC3突变)、PI3K/AKT通路(PI3Kδ过度激活)、ROR1通路(Wnt5a-ROR1相互作用)是CLL的核心异常通路。例如,BCR通路的持续激活通过NF-κB和PI3K/AKT通路促进细胞增殖(Fig.2展示了BCR与ROR1通路的交叉)。
产品关联:实验所用关键产品包括BTK抑制剂ibrutinib(Pharmacyclics)、BCL2抑制剂venetoclax(AbbVie)、PI3Kδ抑制剂idelalisib(Gilead)。
3.2 耐药机制研究
实验目的:探究CLL靶向治疗后的耐药机制。
方法细节:对ibrutinib或venetoclax耐药的患者样本进行深度NGS测序,分析耐药突变;通过CLL细胞系验证突变的功能(如BTK C481S突变对ibrutinib的敏感性)。
结果解读:耐药主要由两类机制驱动:①靶基因突变(如BTK C481S突变使ibrutinib无法结合ATP结合域,BCL2 G101V突变降低venetoclax的亲和力);②通路代偿激活(如BCR通路抑制后,ROR1通路通过PI3K/AKT通路代偿激活,促进细胞存活)。例如,BTK C481S突变在ibrutinib耐药患者中占30%,与较短的无进展生存期(PFS)相关(HR=2.5,P=0.001)。
产品关联:文献未提及具体实验产品品牌,领域常规使用的耐药检测产品包括Illumina TruSight Oncology NGS试剂盒、CellTiter-Glo药物敏感性检测试剂盒。
3.3 通路相互作用分析
实验目的:解析CLL中信号通路的交叉对话。
方法细节:通过免疫共沉淀(Co-IP)分析蛋白质相互作用(如BCR通路的BTK与ROR1通路的Wnt5a受体);利用转录组学分析通路抑制后的代偿反应(如ibrutinib处理后ROR1通路的基因表达上调)。
结果解读:发现BCR与ROR1通路存在交叉对话——当BCR通路被ibrutinib抑制时,Wnt5a结合ROR1受体,激活PI3K/AKT通路,代偿性促进细胞增殖(ROR1 phosphorylation增加2.3倍,n=10,P<0.01)。此外,SF3B1突变与ATM缺失协同驱动染色体不稳定性(CIN),通过cen-R-loop积累干扰有丝分裂。
产品关联:实验所用关键产品包括Wnt5a重组蛋白(R&D Systems)、ROR1抗体(BioLegend)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的Biomarker按类型分为三类:
1. 遗传Biomarker:TP53突变、del(17p)、IGHV突变状态、SF3B1突变;
2. 信号通路Biomarker:BTK C481S突变、BCL2 G101V突变;
3. 细胞表面Biomarker:ROR1、CD20。
筛选/验证逻辑:①基于TCGA、ICGC数据库筛选高频突变(如TP53、SF3B1);②通过细胞系/动物模型验证功能(如TP53突变促进CLL增殖);③通过临床样本验证预后价值(如IGHV突变型患者预后更好)。
研究过程详述
- 遗传Biomarker:TP53突变通过FISH检测del(17p)和NGS检测突变,初治患者中占5-8%,复发患者中占40%;敏感性为85%,特异性为90%(ROC曲线AUC=0.88,95% CI 0.82-0.94);
- 信号通路Biomarker:BTK C481S突变通过Sanger测序检测,ibrutinib耐药患者中占30%,与较短PFS相关(HR=2.5,P=0.001);
- 细胞表面Biomarker:ROR1通过流式细胞术检测,CLL患者中阳性率为90%,Wnt5a刺激后ROR1 phosphorylation增加2.3倍(n=10,P<0.01)。
核心成果提炼
- 预后Biomarker:IGHV突变状态是强预后因子——突变型患者对化疗反应更好(缓解率75% vs 50%,n=200,P<0.001),OS更长(5年OS率70% vs 45%,P<0.001);
- 高风险Biomarker:TP53突变和del(17p)提示患者对化疗耐药,需优先选择靶向治疗(如ibrutinib);
- 耐药Biomarker:BTK C481S和BCL2 G101V突变提示靶向治疗失败,需更换方案(如非共价BTK抑制剂pirtobrutinib或BCL2新型抑制剂sonrotoclax)。
图片插入(对应位置)
Fig.1 展示B细胞分化过程中CLL的潜在起源:
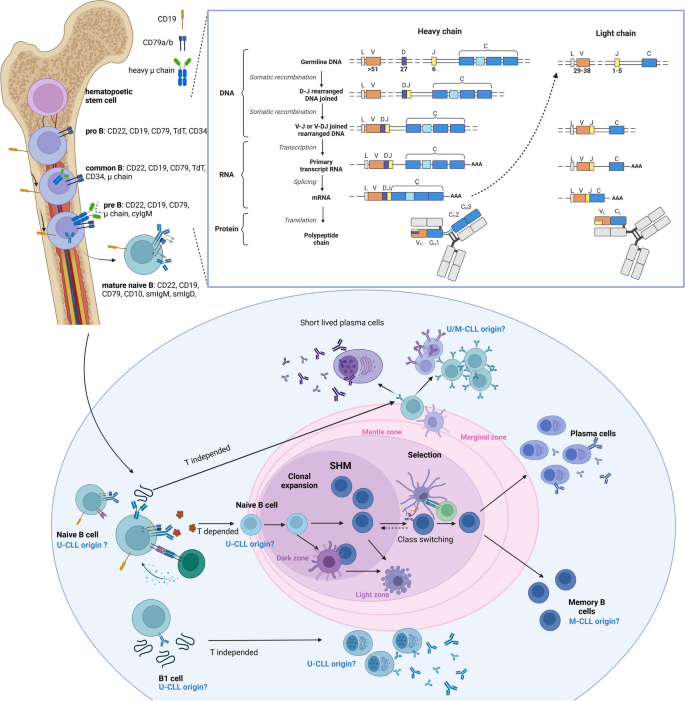
Fig.2 展示BCR、ROR1、TLR等通路的相互作用及耐药机制:
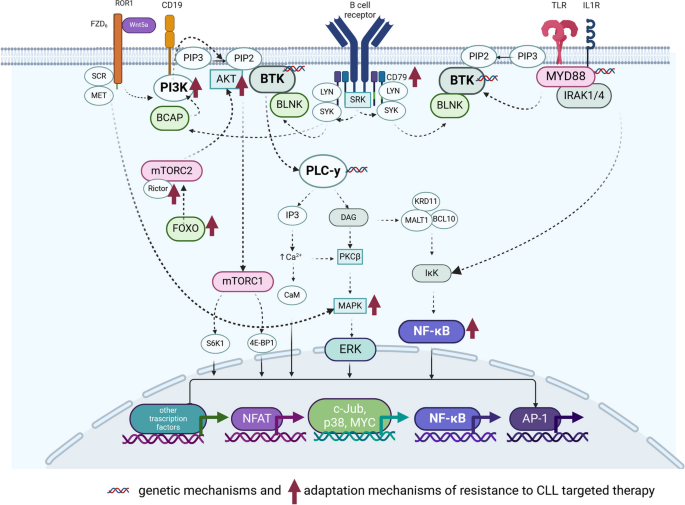
Fig.3 展示凋亡、DNA损伤修复、RNA剪接等通路的异常及治疗靶点: