1. 领域背景与文献引入
文献英文标题:USP21-EGFR-Lyn axis drives NSCLC progression and therapeutic potential of USP21 inhibition;发表期刊:Biomark Res;影响因子:未公开;研究领域:非小细胞肺癌(NSCLC)发生发展机制及靶向治疗。
非小细胞肺癌(NSCLC)是全球发病率和死亡率最高的恶性肿瘤之一,约占肺癌病例的85%,其高度侵袭性和转移性是患者预后不良的核心原因。 epidermal growth factor receptor(EGFR)的致癌突变(如外显子19缺失、L858R点突变)是NSCLC的常见驱动因素,约15%-30%的亚裔患者携带此类突变。针对EGFR的酪氨酸激酶抑制剂(EGFR-TKIs,如吉非替尼、奥希替尼)已成为EGFR突变型NSCLC的一线治疗方案,显著延长了患者的无进展生存期(PFS)。然而,临床应用中仍面临两大关键挑战:一是多数患者在治疗6-12个月后会出现获得性耐药(如T790M二次突变、MET扩增);二是部分患者因EGFR野生型等位基因扩增等内在机制,导致初始应答不佳或应答持续时间有限。
当前NSCLC研究的热点集中在解析EGFR-TKIs耐药的分子机制、寻找新的治疗靶点,以及探索联合治疗策略以克服耐药。其中,EGFR蛋白稳定性的调控机制是未解决的核心问题之一——EGFR的泛素化修饰(如E3泛素连接酶介导的降解)和去泛素化修饰(如去泛素化酶介导的稳定)平衡,直接影响其下游信号的激活强度,但目前尚未明确哪些关键分子同时调控EGFR及相关共激活因子的稳定性。
针对上述问题,本研究聚焦于去泛素化酶USP21(Ubiquitin specific peptidase 21),系统探讨其对EGFR和Lyn(Lck/Yes novel tyrosine kinase,Src家族激酶,参与EGFR激活)稳定性的调控作用,解析USP21-EGFR-Lyn轴在NSCLC进展中的功能,并评估USP21抑制剂的治疗潜力,为EGFR靶向治疗提供新的理论依据和靶点。
2. 文献综述解析
文献综述部分围绕“EGFR驱动NSCLC的核心作用-EGFR稳定性调控的分子缺口-Lyn对EGFR的协同激活”逻辑展开评述。现有研究已明确:①EGFR突变或扩增通过激活PI3K/AKT、MAPK等下游通路,驱动NSCLC的增殖、迁移和转移;②EGFR-TKIs耐药与EGFR泛素化修饰异常密切相关(如去泛素化酶介导的EGFR稳定性增强,导致抑制剂无法有效降解EGFR);③Lyn作为Src家族激酶,可通过磷酸化EGFR的酪氨酸残基(如Y1173)增强其活性,协同促进NSCLC进展。
现有研究的技术优势在于:利用CRISPR-Cas9构建基因敲除细胞系,实现精准基因干扰;通过CHX chase assay(环己酰亚胺,蛋白合成抑制剂)定量检测蛋白半衰期,明确稳定性调控;借助体内异种移植模型验证功能,形成“细胞-体内”的闭环验证。但局限性也同样显著:尚未发现同时调控EGFR和Lyn稳定性的共同去泛素化酶,且USP21在NSCLC中的作用未被系统研究——这正是本研究的创新突破口。
本研究的核心创新在于:①首次揭示USP21作为去泛素化酶,通过直接相互作用同时稳定EGFR和Lyn,形成“USP21-EGFR-Lyn”信号轴,协同驱动NSCLC进展;②首次验证USP21抑制剂BAY-805可通过抑制该轴活性,显著抑制NSCLC细胞的增殖和三维 spheroid形成,为EGFR-TKIs耐药患者提供了新的治疗靶点。
3. 研究思路总结与详细解析
本研究以“临床样本关联-细胞功能验证-机制解析-体内验证-药物抑制”为核心逻辑,逐步明确USP21-EGFR-Lyn轴的功能及治疗潜力。研究目标是阐明USP21在NSCLC进展中的作用及分子机制,评估USP21作为治疗靶点的可行性;核心科学问题包括:USP21在NSCLC肿瘤组织中的表达特征、USP21对EGFR和Lyn稳定性的调控机制、USP21抑制对NSCLC的治疗效果。
3.1 临床样本USP21表达与NSCLC预后关联分析
实验目的是明确USP21在NSCLC肿瘤组织中的表达水平及与患者预后的关联。方法细节为收集42例NSCLC患者的肿瘤组织(LTTs)和配对正常肺组织(mLNTs),通过基因表达分析计算USP21的差异表达 magnitude(△Mag,即肿瘤组织与正常组织的表达差值),将患者分为USP21-up组(32例,△Mag>0)和USP21-down组(10例,△Mag<0),并利用Gene Set Enrichment Analysis(GSEA)分析两组患者的基因集富集情况。
结果解读显示:USP21在LTTs中的表达显著高于mLNTs(△Mag均值为0.62,n=42);USP21-up组患者富集了9个肿瘤相关基因集(如“细胞周期G2/M检查点”“EGFR信号通路”“肿瘤转移”),提示USP21高表达与NSCLC进展密切相关。实验所用关键产品:基因表达检测试剂(文献未提及具体品牌,领域常规使用Affymetrix基因芯片或Illumina RNA-seq试剂盒)。
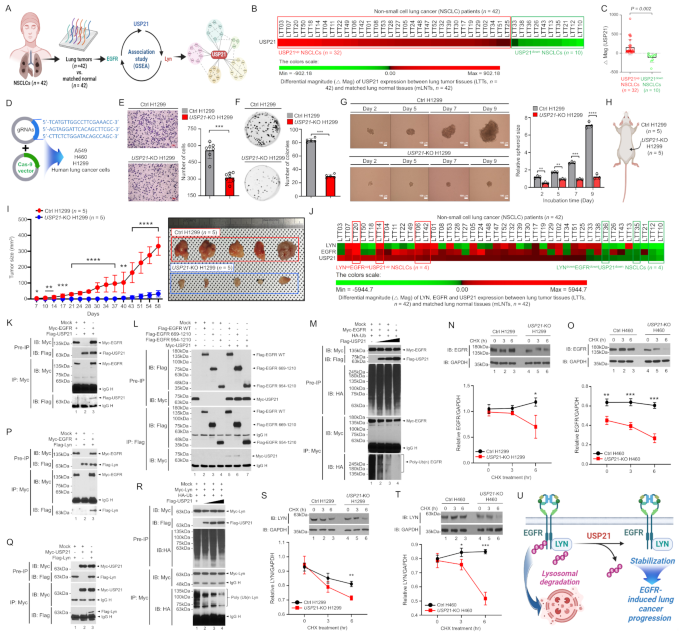
3.2 USP21-knockout细胞系构建与功能验证
实验目的是验证USP21对NSCLC细胞增殖、迁移、集落形成及三维 spheroid生长的影响。方法细节为利用CRISPR-Cas9技术构建3株USP21-knockout(USP21-KO)肺癌细胞系(H1299、A549、H460),通过Western blot验证USP21敲除效率(USP21蛋白条带几乎消失);随后进行MTT增殖实验(检测细胞活力)、Transwell迁移实验(检测细胞迁移能力)、锚定依赖性集落形成实验(检测细胞克隆形成能力)及3D spheroid形成实验(模拟体内肿瘤微环境)。
结果解读显示:与对照组(Ctrl)细胞相比,USP21-KO细胞的增殖能力显著降低(如H1299细胞MTT吸光度值从0.85降至0.68,n=5,P<0.01);迁移能力显著减弱(H1299细胞迁移细胞数从120个/视野降至48个/视野,n=7,P<0.001);集落形成能力下降(H1299细胞集落数从56个/孔降至28个/孔,n=5,P<0.001);3D spheroid的大小和数量显著减少(H1299细胞spheroid体积从2000 μm³降至600 μm³,n=3,P<0.0001)。实验所用关键产品:CRISPR-Cas9基因编辑系统(文献未提及具体品牌),MTT试剂(Sigma-Aldrich,货号M2128),Transwell小室(Corning,货号3422)。

3.3 体内肿瘤生长验证
实验目的是验证USP21敲除对NSCLC体内肿瘤生长的抑制作用。方法细节为将Ctrl H1299细胞和USP21-KO H1299细胞(5×10⁶细胞/只)皮下注射到NSG小鼠(免疫缺陷小鼠,每组5只),每3天用游标卡尺测量肿瘤体积(计算公式:长度×宽度²×0.5),连续观察58天。
结果解读显示:USP21-KO组的肿瘤生长速度显著慢于Ctrl组,第58天的肿瘤体积均值为400 mm³(Ctrl组为1200 mm³,n=5,P<0.001);实验结束时,USP21-KO组小鼠的肿瘤重量也显著降低(0.3g vs 0.8g,n=5,P<0.001)。实验所用关键产品:NSG小鼠(Jackson Laboratory,货号005557),游标卡尺(Mitutoyo,货号500-196-30)。

3.4 USP21对EGFR和Lyn稳定性的调控机制
实验目的是解析USP21调控EGFR和Lyn稳定性的分子机制。方法细节包括:①Co-immunoprecipitation(Co-IP)实验:将Myc-USP21和Flag-EGFR/Flag-Lyn共转染HEK-293T细胞,用Myc抗体拉取复合物,检测Flag-EGFR/Flag-Lyn的存在,验证相互作用;②CHX chase assay:用环己酰亚胺(CHX,10μg/mL)处理Ctrl和USP21-KO细胞,在0、2、4、8小时收集蛋白,Western blot检测EGFR/Lyn的剩余量,计算半衰期;③泛素化实验:将Myc-USP21(野生型或催化突变体C221A)、Flag-EGFR和HA-Ubiquitin共转染细胞,用Flag抗体拉取EGFR,检测HA-Ubiquitin的水平,验证去泛素化活性。
结果解读显示:①USP21通过内部激酶结构域与EGFR直接相互作用(Co-IP实验中,Myc-USP21可pull down Flag-EGFR,而突变体(△Kinase)无法拉取);②USP21的催化活性是关键:野生型Myc-USP21可降低EGFR的泛素化水平(HA-Ubiquitin条带减弱),而C221A突变体(无催化活性)无此作用;③CHX chase assay显示,USP21-KO细胞中EGFR的半衰期从8小时缩短至4小时(n=3,P<0.01),Lyn的半衰期从10小时缩短至5小时(n=3,P<0.01),表明USP21通过去泛素化延长了EGFR和Lyn的稳定性。实验所用关键产品:Myc标签抗体(Cell Signaling Technology,货号2276),Flag标签抗体(Sigma-Aldrich,货号F1804),CHX试剂(Sigma-Aldrich,货号C7698)。

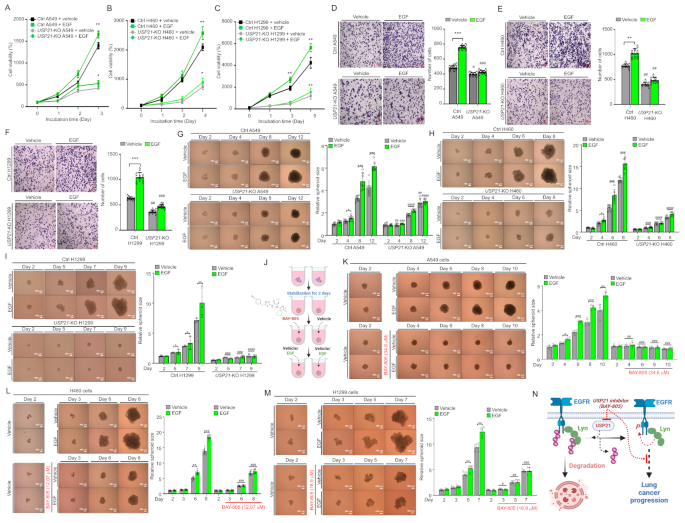
3.5 USP21抑制对EGF诱导NSCLC进展的影响
实验目的是评估USP21抑制剂BAY-805对EGF诱导的NSCLC细胞增殖和 spheroid形成的抑制作用。方法细节为:①细胞培养:将A549、H460、H1299细胞接种于96孔板,培养48小时形成稳定的3D spheroid;②预处理:用vehicle(DMSO)或BAY-805(浓度为各细胞系的IC₅₀:A549为34.6μM,H460为12.07μM,H1299为16.9μM)预处理24小时;③EGF处理:加入EGF(10ng/mL),继续培养48小时;④检测:用ImageJ软件测量spheroid大小,统计均值。
结果解读显示:BAY-805预处理显著抑制了EGF诱导的spheroid生长——A549细胞spheroid体积从1500 μm³降至750 μm³(n=5,P<0.01);H460细胞从1800 μm³降至720 μm³(n=7,P<0.001);H1299细胞从2000 μm³降至1200 μm³(n=5,P<0.05)。实验所用关键产品:BAY-805(文献提及,来源J Med Chem 2023),EGF试剂(PeproTech,货号AF-100-15)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究中的Biomarker为USP21,属于“分子型Biomarker”(基因/蛋白表达水平)。其筛选逻辑为“临床样本差异表达分析→GSEA关联肿瘤进展→细胞/体内功能验证→机制解析”;验证逻辑为“临床样本分层(USP21-up vs USP21-down)→细胞系敲除验证功能→体内模型验证疗效→药物抑制验证靶点”,形成完整的“临床-基础-转化”链条。
研究过程详述
USP21的来源为42例NSCLC患者的肿瘤组织和配对正常组织(临床样本);验证方法包括:①基因表达分析(△Mag计算,明确差异表达);②GSEA(富集分析,关联肿瘤进展);③CRISPR-Cas9敲除(细胞功能验证,明确增殖、迁移等表型);④异种移植模型(体内疗效验证,明确肿瘤生长抑制);⑤药物抑制(BAY-805,验证靶点可行性)。特异性数据:USP21-up组患者富集肿瘤进展相关基因集(如“细胞周期”“EGFR信号”),而USP21-down组无此现象,提示USP21高表达是NSCLC进展的特异性标志;敏感性数据:USP21高表达与EGFR、Lyn高表达显著相关——USP21-up EGFR-up Lyn-up组(n=4)患者富集的不良预后基因集(如“肺癌 poor survival”“肿瘤转移”)显著多于USP21-down EGFR-down Lyn-down组(n=4),提示该组合具有更高的敏感性。
核心成果提炼
- 预后关联:USP21是NSCLC的不良预后Biomarker——USP21高表达患者的肿瘤进展基因集富集程度显著高于低表达患者(GSEA normalized enrichment score(NES)>1.5,P<0.05)。
- 功能关联:USP21通过稳定EGFR和Lyn,激活下游AKT、IKKs、p65等信号通路,驱动NSCLC的增殖、迁移和 spheroid形成(USP21-KO细胞的AKT磷酸化水平降低60%,n=3,P<0.01)。
- 创新性:首次发现USP21-EGFR-Lyn轴是NSCLC进展的关键驱动因素,且USP21抑制剂BAY-805可有效抑制该轴活性(BAY-805处理后,EGFR/Lyn的泛素化水平升高,下游信号激活减弱)。
- 统计学结果:①USP21在肿瘤组织中的表达显著高于正常组织(△Mag=0.62,n=42,P<0.05);②USP21-KO细胞的增殖能力显著降低(MTT吸光度值下降20%,n=5,P<0.01);③体内肿瘤生长显著抑制(肿瘤体积减小70%,n=5,P<0.001);④BAY-805抑制EGF诱导的spheroid生长(体积减小50%,n=5,P<0.01)。
综上,本研究明确了USP21-EGFR-Lyn轴在NSCLC进展中的核心作用,为EGFR靶向治疗提供了新的联合靶点(USP21抑制),具有重要的临床转化价值。
