1. 领域背景与文献引入
文献英文标题:18F-FDG PET/CT metrics-based stratification of large B-cell lymphoma receiving CAR-T cell therapy: immunosuppressive tumor microenvironment as a negative prognostic indicator in patients with high tumor burden;发表期刊:Biomarker Research;影响因子:未公开;研究领域:大B细胞淋巴瘤(LBCL)CAR-T细胞治疗预后预测与机制研究。
嵌合抗原受体T(CAR-T)细胞治疗是复发难治LBCL患者的突破性疗法,客观缓解率(ORR)达83%,5年总生存(OS)率42%,但仍有部分患者对治疗响应差,早期识别这类患者并干预是提升疗效的关键。现有研究显示,CAR-T治疗前的18F-氟脱氧葡萄糖正电子发射计算机断层显像(18F-FDG PET/CT)指标(如总代谢肿瘤体积tMTV、最大标准化摄取值SUVmax)与患者预后相关,但单一指标的预测效能有限,且高肿瘤负荷患者响应差的机制尚未明确。在此背景下,本研究纳入90例接受CAR-T治疗的LBCL患者,系统分析筛选期、治疗后1个月(M1)及3个月的18F-FDG PET/CT指标,结合RNA测序(RNA-seq)解析高肿瘤负荷患者的免疫微环境特征,旨在构建更精准的预后预测模型,并揭示其潜在机制。
2. 文献综述解析
文献综述的核心逻辑围绕“CAR-T治疗LBCL的疗效局限→现有PET/CT指标的应用与不足→本研究的创新方向”展开:作者首先总结CAR-T细胞治疗显著改善复发难治LBCL患者预后,但约30%患者仍会早期进展,强调早期预测的必要性;接着回顾现有研究:tMTV、SUVmax等PET/CT指标可反映肿瘤负荷与代谢活性,与CAR-T治疗后的无进展生存(PFS)、OS相关,但单一指标的预测效能有限(如tMTV对部分患者的区分度不足),且未明确高肿瘤负荷患者响应差的生物学机制;最后指出本研究的创新点:①整合多个PET/CT指标(最大病灶最大直径Dmax、tMTV、总病灶糖酵解量tTLG等),优化预后预测模型;②结合RNA-seq分析高肿瘤负荷患者的肿瘤微环境(TME),探索免疫抑制性微环境对CAR-T疗效的影响。
3. 研究思路总结与详细解析
3.1 患者队列与PET/CT指标收集
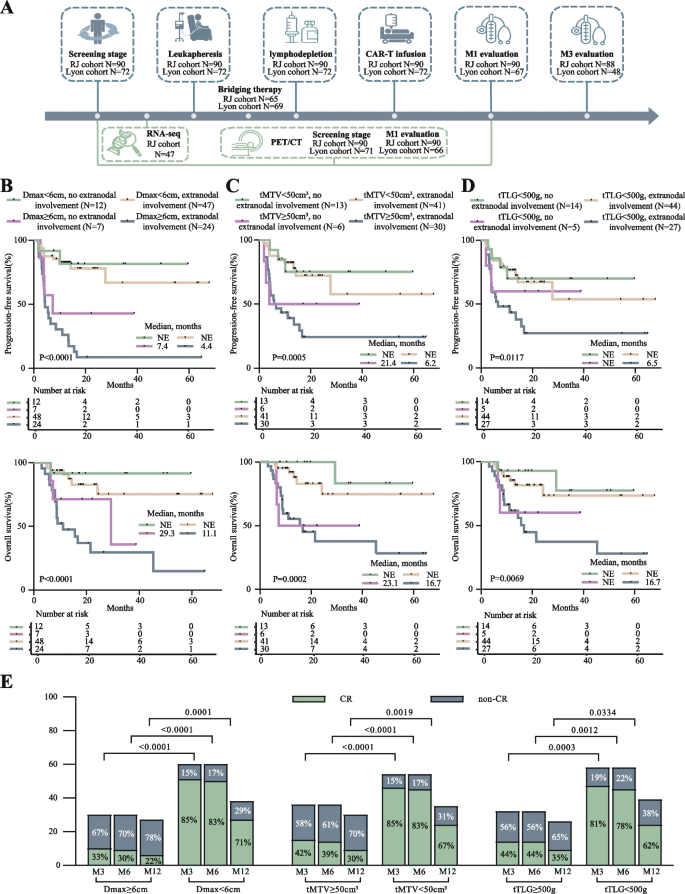
实验目的是获取LBCL患者CAR-T治疗前后的PET/CT指标及临床结局,评估指标与预后的关联。方法为纳入2018年1月至2023年3月在上海瑞金医院接受CAR-T治疗的90例LBCL患者(中位年龄56.5岁,53例男性),收集筛选期(输注前中位53.5天)、M1及治疗后3个月的18F-FDG PET/CT扫描数据,提取Dmax(最大病灶的最大直径)、tMTV、tTLG、SUVmax及最远病灶距离(标准化体表面积)等指标;同时记录患者的3个月完全缓解(CR)率、PFS及OS。结果显示:筛选期Dmax<6cm的患者(60例)3个月CR率(85.0% vs 33.3%,P<0.001)、PFS(风险比HR=0.17,95%置信区间CI=0.08-0.35,P<0.001)及OS(HR=0.18,95%CI=0.08-0.40,P<0.001)显著优于Dmax≥6cm患者(30例);tMTV、tTLG的最佳截断值分别为50cm³、500g,低于截断值的患者预后更好。
文献未提及具体PET/CT扫描仪器,领域常规使用Siemens、GE等品牌的18F-FDG PET/CT扫描仪。
3.2 预后预测模型构建
实验目的是优化PET/CT指标组合,提升预后预测效能。方法为通过单因素及多因素Logistic回归分析,评估筛选期Dmax与结外受累的组合、M1 SUVmax与tTLG清除率(ΔtTLG/tTLGpre,即筛选期与M1 tTLG的差值占筛选期tTLG的比例)的组合对预后的预测价值,并在法国里昂队列(Lyon cohort)中验证。结果显示:①筛选期Dmax结合结外受累的预测效能优于tMTV或tTLG与结外受累/乳酸脱氢酶(LDH)的组合(如Dmax<6cm且无结外受累患者的PFS显著更长);②M1 SUVmax<8且tTLG清除率≥0.9的患者(11例)中位PFS未达到,持续缓解;而SUVmax≥8的患者,无论tTLG清除率高低,均在6个月内进展(tTLG清除率≥0.9者中位PFS 4.2个月,HR=95.0;<0.9者中位PFS 3.7个月,HR=65.2);该模型在里昂队列中验证有效。
3.3 不良反应预测分析
实验目的是探索PET/CT指标与CAR-T治疗不良反应(细胞因子释放综合征CRS、神经毒性NT)的关联。方法为分析阿基仑赛(axi-cel)与瑞基奥仑赛(relma-cel)患者的PET/CT指标与CRS、NT的相关性。结果显示:仅axi-cel患者的最远病灶距离(标准化体表面积)与NT相关,AUC=0.74(P=0.034,95%CI=0.578-0.899);最远病灶距离<0.15m⁻¹的患者无NT发生,而≥0.15m⁻¹者34.8%发生NT;但PET/CT指标与CRS/NT的持续时间、发作时间及CAR-T细胞扩增无显著关联。
3.4 RNA-seq与肿瘤微环境分析
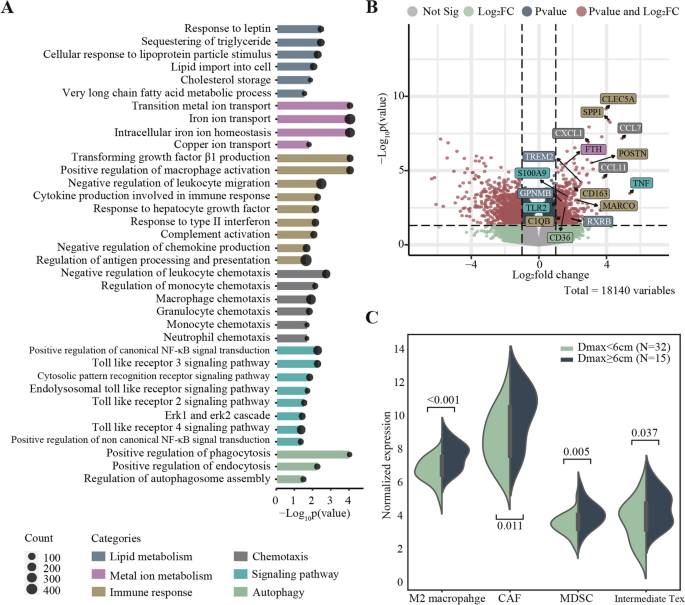
实验目的是解析高肿瘤负荷(Dmax≥6cm)患者对CAR-T治疗响应差的机制。方法为对47例患者筛选期的肿瘤样本进行RNA-seq,通过基因集富集分析(GSEA)和肿瘤微环境细胞组成分析(如M2巨噬细胞、癌症相关成纤维细胞CAF、髓源性抑制细胞MDSC等),比较Dmax<6cm与≥6cm患者的差异。结果显示:Dmax≥6cm患者显著富集免疫抑制相关生物学过程(如巨噬细胞趋化、脂质代谢通路激活);肿瘤微环境中M2巨噬细胞、CAF、MDSC的比例显著增加,中间耗竭T细胞(兼具耗竭与效应功能的T细胞亚群)增多,提示免疫抑制性微环境可能抑制CAR-T细胞的效应功能,导致疗效不佳。
文献未提及具体RNA-seq试剂盒,领域常规使用Illumina NovaSeq测序平台及TRIzol试剂提取RNA。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究的Biomarker包括筛选期PET/CT指标(Dmax、tMTV、tTLG)、M1 PET/CT指标(SUVmax、tTLG清除率),筛选逻辑为:①先通过单因素分析明确单一指标(如Dmax、tMTV)与预后的关联;②再通过多因素分析优化组合指标(如Dmax结合结外受累、M1 SUVmax结合tTLG清除率);③最后结合RNA-seq解析Biomarker的生物学意义。
4.2 研究过程与数据
- Dmax:来源于筛选期PET/CT扫描的最大病灶直径,验证方法为Kaplan-Meier生存分析及Logistic回归。数据显示:Dmax<6cm患者的3个月CR率(85.0% vs 33.3%,P<0.001)、PFS(HR=0.17,P<0.001)及OS(HR=0.18,P<0.001)显著优于Dmax≥6cm患者;其预测3个月CR率的敏感性为85.0%,特异性为66.7%。
- tMTV与tTLG:筛选期tMTV的最佳截断值为50cm³,tTLG为500g;tMTV<50cm³患者的3个月CR率(78.3% vs 40.0%,P<0.001)、PFS(HR=0.22,P<0.001)显著更优;tTLG<500g患者的结果类似。
- M1 SUVmax与tTLG清除率:M1 SUVmax<8且tTLG清除率≥0.9的患者持续缓解,而SUVmax≥8的患者早期进展,该组合在里昂队列中验证有效(AUC=0.82)。
4.3 核心成果与创新性
- 功能关联:①筛选期Dmax是预测CAR-T治疗预后的最优单一指标(AUC最大,P值最显著);②M1 SUVmax与tTLG清除率的组合可精准预测PR/SD患者的早期进展;③axi-cel患者的最远病灶距离可预测NT发生。
- 创新性:①首次发现Dmax结合结外受累的预测效能优于现有指标组合;②构建并验证了M1 PET/CT指标的组合模型,提升了PR/SD患者的早期预测准确性;③首次通过RNA-seq揭示高肿瘤负荷患者的免疫抑制性微环境(M2巨噬细胞、CAF、MDSC增加,中间耗竭T细胞增多)是CAR-T疗效差的关键机制,为靶向免疫微环境的联合治疗提供了理论依据。
综上,本研究通过18F-FDG PET/CT指标分层LBCL患者,构建了更精准的预后预测模型,并揭示了免疫抑制性微环境在高肿瘤负荷患者中的不良预后作用,为CAR-T治疗的个体化管理及机制研究提供了重要参考。
