1. 领域背景与文献引入
文献英文标题:A circular RNA blood panel that differentiates Alzheimer’s disease from other dementia types;发表期刊:Biomarker Research;影响因子:未公开;研究领域:阿尔茨海默病(AD)生物标志物研究。
阿尔茨海默病是全球最常见的神经退行性痴呆类型,其患病率随人口老龄化逐年上升,严重影响患者生活质量并给家庭及社会带来沉重负担。目前AD诊断主要依赖神经影像(如PET-CT)或脑脊液(CSF)生物标志物(如Aβ42、P-tau),但神经影像检查成本高、耗时长,脑脊液穿刺为有创操作,限制了其在大规模人群筛查中的应用。此外,AD与血管性痴呆(VaD)、帕金森病痴呆(PDD)、行为变异型额颞叶痴呆(bvFTD)、路易体痴呆(DLB)等其他痴呆类型的临床症状、病理特征及生物标志物存在显著重叠,导致临床鉴别诊断困难。因此,开发无创、便捷且能特异性区分AD与其他痴呆的外周血生物标志物是当前AD研究的关键方向。
环状RNA(circRNA)是一类具有闭合环状结构的非编码RNA,具有稳定性高、组织特异性强、不易降解的特点,近年研究发现其在AD患者脑内(如大脑皮层)及外周血(如外周血单个核细胞)中存在差异表达,有望成为AD诊断的新型生物标志物。但现有研究多聚焦于AD与健康对照的比较,样本量小且未涉及与其他痴呆类型的鉴别,限制了其临床转化。本研究针对这一空白,通过多中心、大样本量研究,探索circRNA作为外周血生物标志物区分AD与健康对照及其他痴呆类型的潜力,旨在建立高效、特异的AD诊断模型。
2. 文献综述解析
文献综述部分,作者围绕“AD诊断生物标志物的现状”“circRNA与AD的关联研究”两大维度展开系统评述,清晰梳理了现有研究的进展与局限。
首先,作者总结了AD诊断生物标志物的研究现状:脑脊液中的Aβ42(淀粉样蛋白)、总tau(T-tau)、磷酸化tau(P-tau)是AD的核心病理标志物,其水平变化能直接反映AD的病理进程,但脑脊液采集需腰椎穿刺,属于有创操作,患者接受度低,难以用于大规模人群筛查;血液中的Aβ42/40比值、神经丝轻链蛋白(NFL)、P-tau181等标志物虽具有无创性优势,但检测需专业技术设备,成本较高,且诊断效能仍需提升。
其次,作者梳理了circRNA与AD的关联研究:近年研究发现,circRNA在AD患者脑内(如颞叶皮层)及外周血(如外周血单个核细胞)中存在显著差异表达,部分circRNA通过海绵吸附miRNA(如ciRS-7吸附miR-7,抑制Aβ清除)或结合蛋白质(如circNF1-419结合Dynamin-1,调控自噬)参与AD的病理过程。但现有研究存在三大局限:①样本量小,部分研究仅纳入5例AD患者,结果可靠性不足;②未验证circRNA对其他痴呆类型的鉴别能力,无法满足临床鉴别诊断需求;③机制研究不深入,多数研究仅报道circRNA的差异表达,未阐明其参与AD病理的具体机制。
基于现有研究的不足,本研究的创新点显著:①首次构建circRNA血液panel,系统验证其区分AD与其他痴呆类型(VaD、PDD、bvFTD、DLB)的能力;②采用多中心、大样本量设计(共纳入485例受试者),涵盖健康对照、AD及5种其他痴呆类型,结果可靠性高;③通过“筛选-建模-验证”的闭环研究思路,确保诊断模型的稳定性与重复性。
3. 研究思路总结与详细解析
本研究采用“pilot研究筛选差异circRNA→模型建立→外部验证”的闭环思路,分三个关键环节展开,最终建立并验证了能区分AD与其他痴呆的六circRNA诊断模型。
3.1 pilot研究(Dataset1)筛选差异circRNA
实验目的:筛选AD患者与健康对照间的差异表达circRNA,为后续模型建立提供候选标志物。
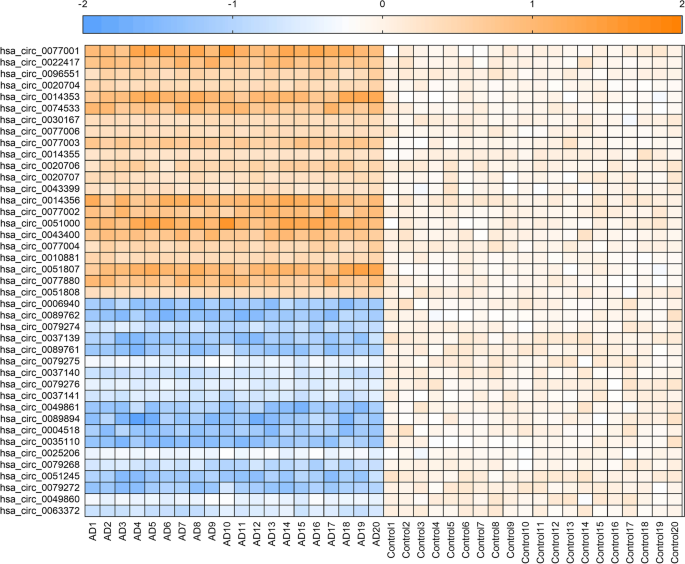
方法细节:纳入Dataset1(n=40,健康对照20例,AD患者20例),采集受试者空腹12小时后的外周静脉血(EDTA抗凝),分离血浆后采用miRNeasy Serum Kit(Qiagen)提取总RNA;通过Ribo-off rRNA Depletion Kit(Vazyme)去除核糖体RNA,再用RNase R(New England Biolabs)降解线性RNA,富集circRNA;构建测序文库后,利用BGISEQ-500平台进行高通量测序;采用DESeq2软件分析差异表达circRNA(筛选标准:Q≤0.05,fold change≥1.2或≤0.8)。
结果解读:测序结果显示,AD患者血浆中有22个circRNA上调、19个circRNA下调(Q≤0.05),热图(Fig.1)直观展示了这些差异circRNA的表达模式(橙色代表上调,蓝色代表下调)。
实验所用关键产品:Qiagen的miRNeasy Serum Kit、Vazyme的Ribo-off rRNA Depletion Kit、New England Biolabs的RNase R、BGISEQ-500测序平台。
3.2 Dataset2建立六circRNA诊断模型
实验目的:基于pilot研究筛选的差异circRNA,构建能区分AD与健康对照的诊断模型。
方法细节:纳入Dataset2(n=124,健康对照61例,AD患者63例),采用与Dataset1一致的方法提取血浆circRNA并检测其表达;从Dataset1的41个差异circRNA中选取前6个上调(hsa_circ_0077001、hsa_circ_0022417、hsa_circ_0014356、hsa_circ_0014353、hsa_circ_0074533)和前6个下调(hsa_circ_0006940、hsa_circ_0089762、hsa_circ_0089894、hsa_circ_0037139、hsa_circ_0089761、hsa_circ_0079275)的circRNA作为候选标志物;以“AD vs 健康对照”为因变量,候选circRNA及年龄、性别、教育年限、APOE ε4(载脂蛋白Eε4,AD风险基因)状态为协变量,构建二元逻辑回归模型,通过逐步向前回归筛选进入模型的circRNA;采用受试者工作特征(ROC)曲线评估模型的诊断效能。
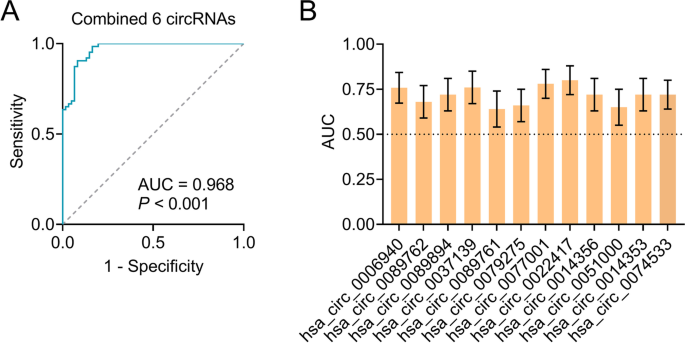
结果解读:Dataset2验证了Dataset1中的41个差异circRNA(P<0.05),表明pilot研究结果可靠;逻辑回归分析显示,5个上调circRNA(hsa_circ_0077001、hsa_circ_0022417、hsa_circ_0014356、hsa_circ_0014353、hsa_circ_0074533)和1个下调circRNA(hsa_circ_0089894)进入最终模型,年龄、性别等协变量因无统计学意义被排除(P>0.05);ROC曲线分析显示,该六circRNA panel区分AD与健康对照的曲线下面积(AUC)为0.968(P<0.001,Fig.3A),显著高于单个circRNA的AUC(0.636-0.796,Fig.3B),表明panel的诊断效能远优于单个circRNA。此外,基因本体(GO)分析显示,这6个circRNA参与细胞过程、代谢过程、免疫反应及突触功能等与AD密切相关的生物学过程;京都基因与基因组百科全书(KEGG)分析显示其富集于PI3K-Akt信号通路、胰岛素抵抗等AD相关通路,提示其可能通过调控这些通路参与AD的病理进程。
实验所用关键产品:同3.1(miRNeasy Serum Kit、Ribo-off rRNA Depletion Kit、RNase R、BGISEQ-500)。
3.3 Dataset3验证模型区分AD与其他痴呆的能力
实验目的:验证六circRNA panel区分AD与其他痴呆类型(VaD、PDD、bvFTD、DLB)的能力,评估其临床实用性。
方法细节:纳入Dataset3(n=321,健康对照58例,AD患者60例,VaD患者50例,PDD患者51例,bvFTD患者52例,DLB患者50例),采用与前两个数据集一致的方法提取血浆circRNA并检测其表达;分析六circRNA在不同痴呆类型中的表达差异,并通过ROC曲线评估panel区分AD与其他痴呆的效能。
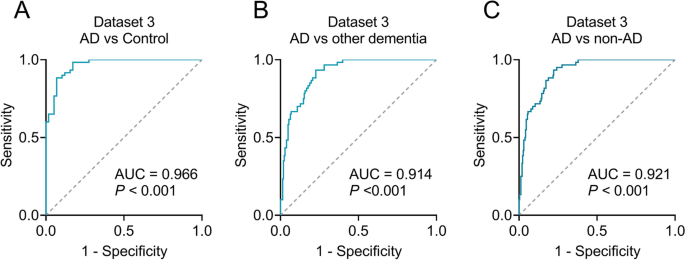
结果解读:Dataset3中,AD患者血浆中5个上调circRNA(hsa_circ_0077001、hsa_circ_0022417、hsa_circ_0014356、hsa_circ_0014353、hsa_circ_0074533)的表达水平显著高于健康对照及VaD、PDD、bvFTD、DLB患者(P<0.001),而下调circRNA(hsa_circ_0089894)的表达水平显著低于健康对照及其他痴呆患者(P<0.001,Fig.4A-F);其他痴呆类型(VaD、PDD、bvFTD、DLB)中,六circRNA的表达均无显著差异(P>0.05),表明其具有AD特异性;ROC曲线分析显示,该panel区分AD与健康对照的AUC为0.966(P<0.001,Fig.5A),区分AD与其他痴呆的AUC为0.914-0.966(P<0.001,Fig.5B-C),验证了模型的高特异度与灵敏度。
实验所用关键产品:同3.1。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究开发的六circRNA panel(hsa_circ_0077001、hsa_circ_0022417、hsa_circ_0014356、hsa_circ_0014353、hsa_circ_0074533上调;hsa_circ_0089894下调)是一种AD特异性外周血生物标志物。其筛选与验证遵循“三步法”逻辑:①通过pilot研究(Dataset1)筛选AD与健康对照间的差异circRNA;②通过Dataset2构建并优化诊断模型,筛选出效能最优的六circRNA panel;③通过Dataset3验证模型区分AD与其他痴呆的能力,形成“筛选-建模-验证”的完整链条,确保Biomarker的可靠性与稳定性。
研究过程详述
Biomarker来源:外周血血浆,采集自多中心受试者(空腹12小时,EDTA抗凝),无创且易获取。
验证方法:①通过RNA测序(Dataset1)筛选差异circRNA;②通过定量检测(Dataset2、3)验证差异circRNA的表达水平;③通过ROC曲线分析评估Biomarker的诊断效能。
特异性与敏感性:①特异性:六circRNA仅在AD患者中显著改变,在VaD、PDD、bvFTD、DLB等其他痴呆患者中无差异表达(P>0.05),能有效区分AD与其他痴呆;②敏感性与特异性:Dataset2中区分AD与健康对照的AUC为0.968(P<0.001),Dataset3中区分AD与其他痴呆的AUC为0.914-0.966(P<0.001),表明其具有高敏感性与特异性。
核心成果提炼
本研究的核心成果是建立了首个能有效区分AD与其他痴呆类型的circRNA血液panel,具有以下四大优势:
1. 无创性:基于外周血血浆,无需腰椎穿刺或影像学检查,患者接受度高,适合大规模人群筛查。
2. 高特异性:仅在AD患者中显著改变,能有效区分AD与VaD、PDD、bvFTD、DLB等其他痴呆类型,解决了临床鉴别诊断困难的问题。
3. 高效性:诊断效能优异,AUC高达0.968,远优于单个circRNA及部分现有血液标志物。
4. 稳定性:经过多中心、大样本量验证(共纳入485例受试者),结果可靠,具有临床转化潜力。
此外,该panel的6个circRNA参与AD相关生物学过程(如突触功能、PI3K-Akt通路),推测其可能通过调控这些过程参与AD的病理进程,为AD的发病机制研究提供了新方向。
本研究通过系统的“筛选-建模-验证”流程,开发了一种高效、特异的AD外周血生物标志物,为AD的早期诊断与鉴别诊断提供了新工具,也为circRNA在AD中的临床应用奠定了基础。未来需进一步研究其作用机制,并开展 longitudinal 研究评估其预测AD进展的能力,推动其临床转化。
