1. 领域背景与文献引入
文献英文标题:Identification of TCR Vβ11-2-Dβ1-Jβ1-1 T cell clone specific for WT1 peptides using high-throughput TCRβ gene sequencing;发表期刊:Biomark Res;影响因子:未公开;研究领域:慢性粒细胞白血病(CML)的T细胞免疫治疗。
慢性粒细胞白血病(CML)是成人常见血液恶性肿瘤,分子特征为BCR-ABL融合蛋白导致的异常激酶活性。酪氨酸激酶抑制剂(TKIs)显著改善CML预后,但部分患者存在原发/获得性耐药;造血干细胞移植(HSCT)受限于年龄, donor淋巴细胞输注(DLI)虽能诱导移植物抗白血病效应,但易引发移植物抗宿主病(GVHD)。因此,输注白血病抗原特异性细胞毒性T淋巴细胞(CTLs)成为CML免疫治疗的关键方向。Wilms瘤基因1(WT1)是CML相关肿瘤抗原,在CML细胞中高表达,与疾病进展、TKI耐药密切相关,是潜在免疫治疗靶点。
此前研究发现,CML患者中存在TCR Vβ21克隆,其修饰的T细胞能特异性靶向CML细胞,但该克隆识别的靶抗原尚未明确——这是领域未解决的核心问题。本研究旨在通过WT1肽与BCR-ABL肽刺激健康人T细胞,结合高通量TCRβ测序鉴定抗原特异性TCR克隆,明确Vβ21克隆的靶抗原,为CML的TCR基因修饰T细胞(TCR-T)治疗提供特异性靶点。
2. 文献综述解析
文献综述围绕“CML免疫治疗的局限→白血病抗原特异性CTLs的必要性→WT1与BCR-ABL作为CML靶抗原的合理性→既往Vβ21克隆的研究空白”展开评述逻辑。
现有研究关键结论:① CML免疫治疗需克服TKIs耐药与HSCT限制,白血病抗原特异性CTLs是解决GVHD的理想策略;② WT1在CML中高表达,与疾病进展相关,是潜在免疫靶点;③ 前期研究发现CML患者中的Vβ21克隆能靶向CML细胞,但未明确其识别的抗原。技术方法优势:高通量TCRβ测序可全面解析T细胞受体(TCR) repertoire,捕捉抗原刺激后的克隆扩增;局限性:既往研究未对比不同抗原刺激下的TCR克隆差异,无法明确Vβ21克隆的靶抗原。
文献创新价值:首次通过WT1与BCR-ABL肽分别刺激健康人T细胞,鉴定出WT1特异性的Vβ11-2-Dβ1-Jβ1-1克隆与BCR-ABL特异性的Vβ7-9-Dβ2-Jβ2-7克隆;且Vβ11-2克隆的序列与此前CML患者中的Vβ21克隆(不同命名系统)相似,提示Vβ21克隆可能识别WT1——填补了“Vβ21克隆靶抗原未知”的研究空白,为CML的TCR-T治疗提供了特异性TCR序列。
3. 研究思路总结与详细解析
本研究以“鉴定CML相关抗原特异性TCR克隆、明确Vβ21克隆靶抗原”为目标,核心科学问题是“WT1与BCR-ABL肽分别诱导哪些TCR克隆?CML患者中的Vβ21克隆是否识别WT1?”;技术路线为“健康人T细胞分离→不同抗原刺激培养→高通量TCRβ测序分析repertoire→RT-PCR/ GeneScan/ Sanger测序验证克隆性→序列对比关联既往研究”的闭环。
3.1 CD3+T细胞分离与刺激培养
实验目的:获取不同抗原刺激后的CD3+T细胞,为后续TCR repertoire分析提供样本。
方法细节:从健康供者外周血单核细胞(PBMCs)中用Miltenyi Biotec免疫磁珠分选CD3+T细胞,分为4组:① 对照组(不处理);② 细胞因子组(仅IL-2+IL-7);③ WT1组(WT1肽+IL-2+IL-7,WT1肽序列为RMFPNAPYL);④ BCR-ABL组(6条混合BCR-ABL肽+IL-2+IL-7)。细胞培养3周,每周补加IL-2(2次/周)与IL-7(1次/周)。
结果:成功获得4组培养后的T细胞,无明显细胞死亡(文献未明确存活率数据),可用于后续RNA提取与测序。
实验所用关键产品:免疫磁珠(Miltenyi Biotec)、TRIzol RNA提取试剂(Invitrogen,货号15596)。
3.2 高通量TCRβ基因测序与repertoire分析
实验目的:分析不同刺激组的TCR Vβ repertoire差异,筛选抗原特异性克隆。
方法细节:提取T细胞总RNA,通过5′cDNA末端快速扩增(RACE)扩增TCRβ基因,构建测序文库后用HiSeq/MiSeq测序;用mixcr(v1.8.2)软件筛选有效序列(包含互补决定区3(CDR3)、读长为3的倍数、无终止密码子),统计Vβ/Jβ基因使用频率与VDJ重排类型。
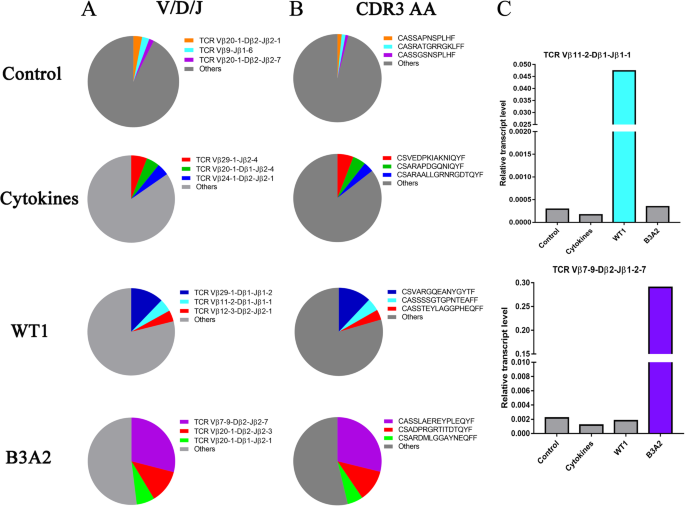
结果:4组的Vβ基因(约60种)、Jβ基因(约14种)、VDJ重排数(约1400种)与独特CDR3序列数无显著差异,但Vβ/Jβ使用频率差异显著:① WT1组Top3 Vβ为Vβ29-1(15.4%)、Vβ12-3(13.5%)、Vβ20-1(10.8%),且Vβ11-2-Dβ1-Jβ1-1克隆频率达4.7%;② BCR-ABL组Top3 Vβ为Vβ7-9(30.3%)、Vβ20-1(24.8%)、Vβ5-1(15.4%),且Vβ7-9-Dβ2-Jβ2-7克隆频率达29.0%;③ 对照组与细胞因子组无明显优势Vβ克隆。
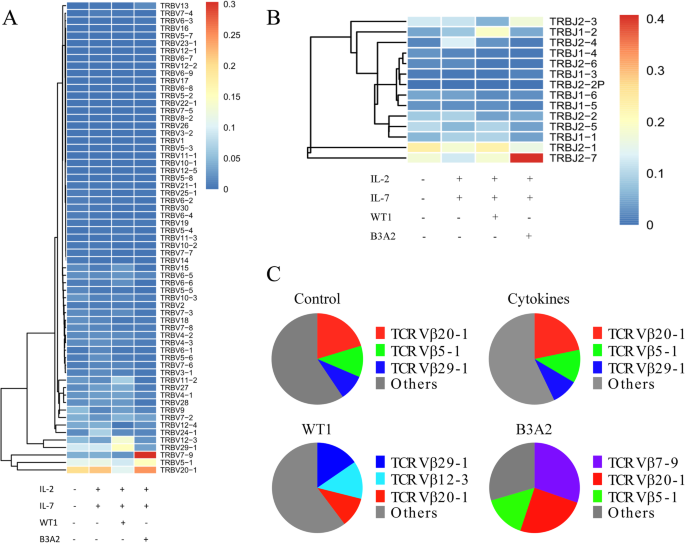
实验所用关键产品:mixcr软件(v1.8.2)、测序服务由华银健康公司提供。
3.3 RT-PCR、GeneScan与Sanger测序验证
实验目的:验证高通量测序筛选的优势克隆的克隆性与CDR3序列。
方法细节:① 用24对TCR Vβ引物与Cβ引物进行RT-PCR,扩增TCR Vβ亚家族;② 部分PCR产物用Sanger测序(Invitrogen)验证VDJ重排;③ 剩余产物用5′端标记FAM荧光的Cβ引物进行 runoff PCR,通过ABI 310 DNA sequenator与GeneScan软件分析克隆性(单峰/双峰提示单克隆/寡克隆)。
结果:① WT1组的Vβ21扩增产物呈双峰(寡克隆),Sanger测序证实为Vβ11-2-Dβ1-Jβ1-1重排,CDR3氨基酸序列为CASSSSGTGPNTEAFF;② BCR-ABL组的Vβ6扩增产物呈双峰,测序证实为Vβ7-9-Dβ2-Jβ2-7重排,CDR3序列为CASSLAEREYPLEQYF;③ 对照组与细胞因子组均呈多峰(多克隆)。
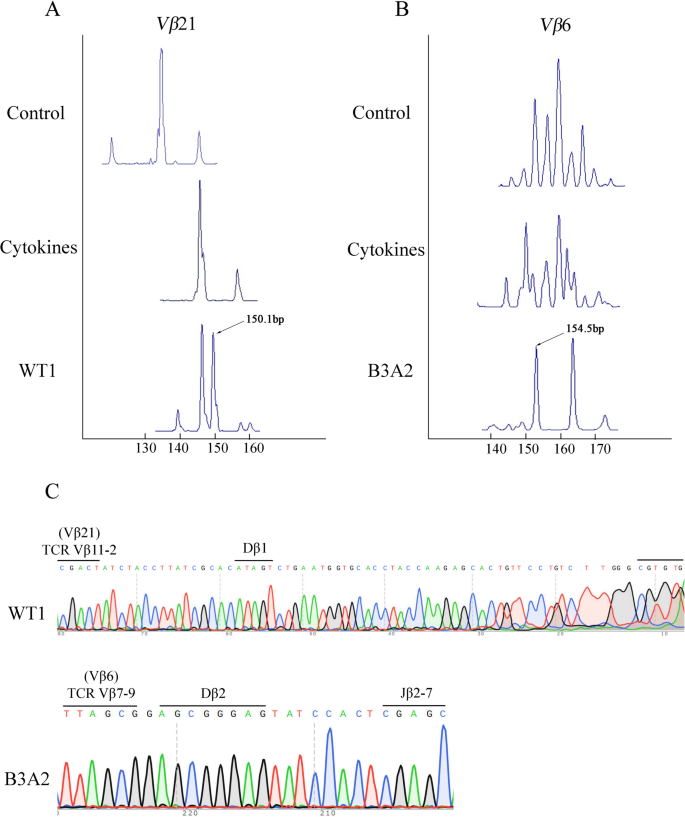
实验所用关键产品:荧光标记Cβ引物(TIB MOLBIOL GmbH)、ABI 310 DNA sequenator、GeneScan-500-LIZ Size Standards(Perkin Elmer)。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本研究涉及的Biomarker为“TCR克隆”(属于T细胞受体型生物标志物),具体包括:① WT1特异性的Vβ11-2-Dβ1-Jβ1-1克隆;② BCR-ABL特异性的Vβ7-9-Dβ2-Jβ2-7克隆。筛选逻辑为“抗原刺激→高通量测序筛选优势克隆→RT-PCR/GeneScan验证克隆性→Sanger测序确认序列”的完整链条。
研究过程详述
Biomarker来源:健康供者PBMC经WT1/BCR-ABL肽刺激后的CD3+T细胞。验证方法:① 高通量测序分析Vβ使用频率,筛选优势克隆;② GeneScan分析克隆性(双峰提示抗原特异性扩增);③ Sanger测序确认VDJ重排与CDR3序列。
特异性数据:① Vβ11-2-Dβ1-Jβ1-1克隆仅在WT1组中高频表达(频率4.7%),其他组无明显扩增;② Vβ7-9-Dβ2-Jβ2-7克隆仅在BCR-ABL组中高频表达(频率29.0%),显著高于其他组(n=每组1个健康供者样本,P值文献未明确)。敏感性数据:WT1组中Vβ11-2克隆的CDR3序列阳性率为4.7%,BCR-ABL组中Vβ7-9克隆阳性率为29.0%(样本量n=1)。
核心成果提炼
- 功能关联:Vβ11-2-Dβ1-Jβ1-1克隆是WT1特异性的,其序列与此前CML患者中的Vβ21克隆(不同命名系统)相似,提示CML患者中的Vβ21克隆可能识别WT1——解决了“Vβ21克隆靶抗原未知”的问题;Vβ7-9-Dβ2-Jβ2-7克隆是BCR-ABL特异性的,为BCR-ABL阳性CML的TCR-T治疗提供靶点。
- 创新性:首次通过抗原刺激与高通量测序,鉴定出WT1特异性的Vβ11-2克隆,并关联了既往CML患者中的Vβ21克隆的靶抗原;首次对比了WT1与BCR-ABL肽刺激后的TCR克隆差异,明确了两种抗原的特异性TCR序列。
- 临床价值:这些克隆可作为CML的T细胞免疫治疗靶点,为制备WT1/BCR-ABL特异性TCR-T细胞提供序列依据,有望克服DLI的GVHD问题。
本研究通过严谨的实验设计,填补了CML中Vβ21克隆靶抗原的空白,为TCR-T治疗提供了特异性生物标志物,具有重要的转化医学价值。
